题目内容
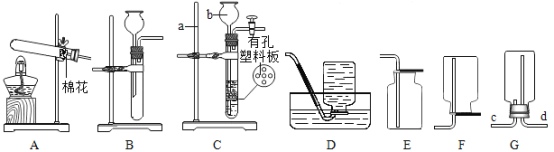
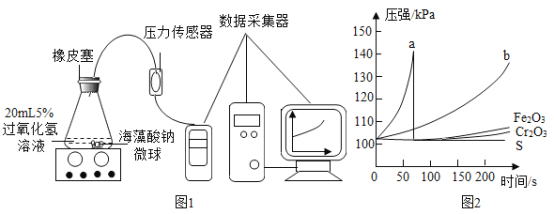
【题目】实验室用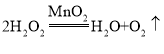 制取氧气,并用排水法收集。
制取氧气,并用排水法收集。
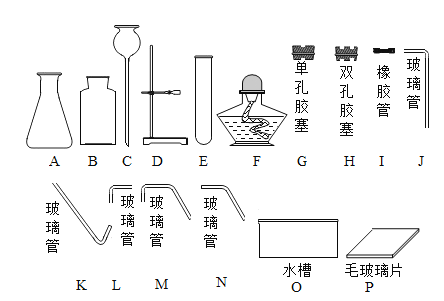
(1)仪器A的名称______________。
(2)组装整套装置时,可选用上图中的A、B、C、H、I、M、O、P和______________。
(3)若制取6.4gO2, 至少需要_____ g 的H2O2完全分解。
(4)选择气体的制取装置时,需要考虑______、反应条件和气体的性质。
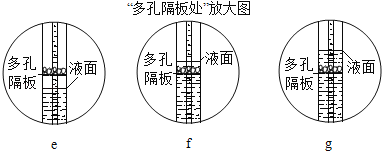
(5)当气泡___________地放出时,再将导管口伸入盛满水的集气瓶收集氧气。
【答案】锥形瓶 K 13.6 反应物的状态 连续并比较均匀
【解析】
(1)仪器A的名称锥形瓶;
(2)过氧化氢法制氧气应用固液常温型发生装置,氧气难溶于水,可用排水法收集;氧气的密度比空气的大,可用向上排空气法收集,组装整套装置时,可选用上图中的A、B、C、H、I、M、O、P和K;
(3)设若制取6.4gO2, 至少需要质量为x的H2O2完全分解,则
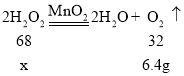
![]() x=13.6g
x=13.6g
(4)选择气体的制取装置时,需要考虑反应物的状态、反应条件和气体的性质;
(5)当气泡连续、均匀地放出时,再将导管口伸入盛满水的集气瓶收集氧气,如果冒出气泡就立即收集,导致收集气体不纯。

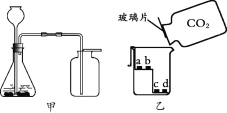
【题目】同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究。
(推理假设)
上述两种物质发生反应的化学方程式为______,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
(实验探究)
(1)确定废液中是否含有盐酸
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的几种物质,其中物质X是酸碱指示剂中的______溶液。
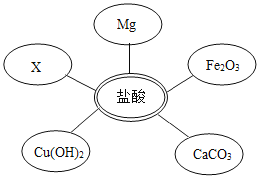
②实验验证:某同学向废液中加入少量的镁粉,观察到废液中______,确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3:某同学选用pH试纸测出废液的pH=10,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计.
方案 | 加入试剂 | 分离方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行 |
二 | 过量的______ | ______ | 可行 |
(4)拓展运用:
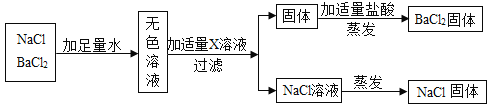
按照如图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是______.
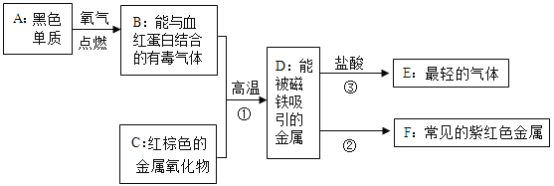
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
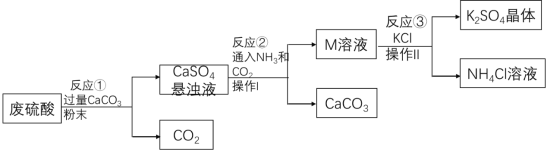
(l)生产上将CaCO3研成粉末的目的是_____;写出反应①的化学方程式:_____,操作I的名称是_____。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是_____(写化学式)。
(3)写出反应③的化学方程式:_____,反应③在常温下能实现的原因是_____。(反应③中相关物质的溶解度见下表)
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(4)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_____。