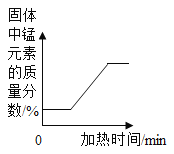
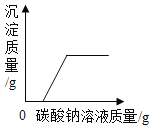
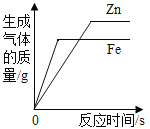
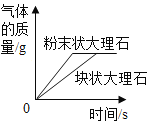
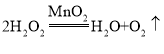题目内容
【题目】(1)大米是入们日常的主食之﹣,它为入体提供的主要营养素是_____。
(2)“加碘盐”含有碘酸钾(KIO3),碘酸钾中碘的化合价是_____。
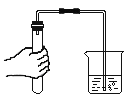
(3)打开盛有白醋的瓶盖时,很快就闻到了酸味。请从微观角度解释_____
(4)丙酸钠(C3H5O2Na)是常用的食品防腐剂,丙酸钠中C、O元素质量比为_____。
(5)生石灰常用作食品干燥剂,其原理_____(用化学方程式表示)
【答案】糖类 ![]() 分子是在不断运动的 9:8 CaO+H2O═Ca(OH)2
分子是在不断运动的 9:8 CaO+H2O═Ca(OH)2
【解析】
(1)根据大米为人体提供的主要营养素进行分析。
(2)根据在化合物中正负化合价代数和为零进行分析。
(3)根据分子的基本特征进行分析。
(4)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答。
(5)根据生石灰与水反应生成氢氧化钙进行分析。
(1)大米中富含淀粉,淀粉属于糖类。故答案为:糖类;
(2)在碘酸钾(KIO3)中,钾元素的化合价为+1价,氧元素的化合价为﹣2价,设碘元素的化合价为x,根据化合物中各元素的化合价代数和为0,则可得:(+1)+(x)+(-2)×3=0,解得x=+5。故答案为:![]() ;
;
(3)打开盛有白醋的瓶盖时,立刻就闻到了酸味,这是因为白醋中的分子是在不断运动,向四周扩散,使人们立刻就闻到了酸味。故答案为:分子是在不断运动的;
(4)丙酸钠(C3H5O2Na)是常用的食品防腐剂,丙酸钠中碳、氧元素的质量比为(12×3):(16×2)=36:32=9:8。故答案为:9:8;
(5)生石灰与水反应生成氢氧化钙,所以可以用于做食品干燥剂。反应的化学方程式为:CaO+H2O═Ca(OH)2。故答案为:CaO+H2O═Ca(OH)2。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
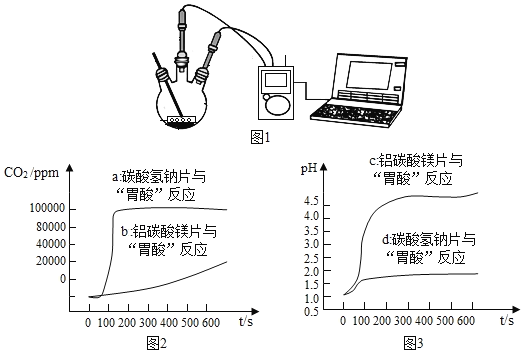
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。