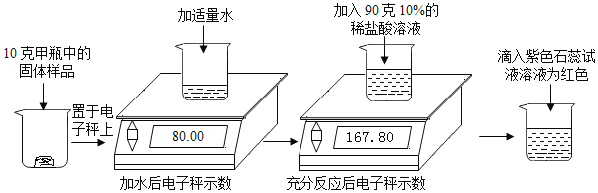
题目内容
【题目】某化工厂用废硫酸制备K2SO4的流程如下:
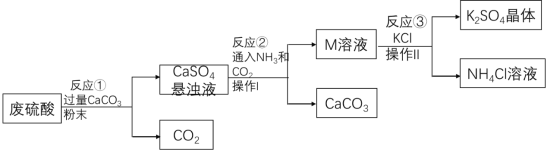
(l)生产上将CaCO3研成粉末的目的是_____;写出反应①的化学方程式:_____,操作I的名称是_____。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是_____(写化学式)。
(3)写出反应③的化学方程式:_____,反应③在常温下能实现的原因是_____。(反应③中相关物质的溶解度见下表)
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
(4)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_____。
【答案】防止生成的微溶物CaSO4附着在CaCO3表面,增大接触面积,加快反应速率 CaCO3+H2SO4==CaSO4+H2O+CO2↑ 过滤 CaCO3 (NH4)2SO4+2KCl==K2SO4↓+NH4Cl K2SO4在常温下溶解度最低,先从溶液中析出晶体 防止K2SO4溶于水,损失样品
【解析】
(l)生产上将CaCO3研成粉末的目的是防止生成的微溶物CaSO4附着在CaCO3表面,增大接触面积,加快反应速率;写出反应①的化学方程式:CaCO3+H2SO4==CaSO4+H2O+CO2↑,操作I的名称是过滤。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是CaCO3。
(3)写出反应③的化学方程式:(NH4)2SO4+2KCl==K2SO4↓+NH4Cl,反应③在常温下能实现的原因是K2SO4在常温下溶解度最低,先从溶液中析出晶体。
(4)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是防止K2SO4溶于水,损失样品。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】下图表示相连线的酸、碱、盐之间可以发生复分解反应,下表提供的四组物质符合左下图要求的是( )
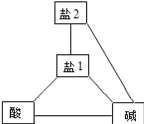
物质 组别 | 酸 | 碱 | 盐1 | 盐2 |
A | H2SO4 | Ca(OH)2 | BaCl2 | Na2CO3 |
B | H2SO4 | Ca(OH)2 | Na2CO3 | BaCl2 |
C | HCl | NaOH | Na2CO3 | BaCl2 |
D | H2SO4 | Ba(OH)2 | Na2CO3 | CuSO4 |
A. AB. BC. CD. D