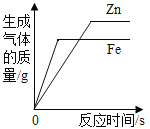
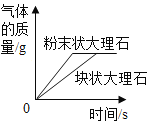
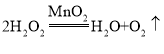题目内容
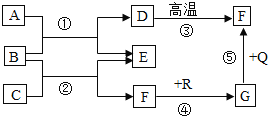
【题目】A-H是初中化学常见的物质,其相互转化关系如图所示(部分反应物和产物己省略)。其中A是人体胃液中帮助消化的物质,B可用于改良酸性土壤。回答下列问题:

(1)上述物质中属于盐类的是________________(填化学式)。
(2)写出符合A→E的化学方程式_________________,B通过复分解反应转化为H的化学方程式为_________________。
(3)上述五个反应中,一定没有发生的基本反应类型是_________________反应。
【答案】CaCl2、CaCO3 ![]() (合理即可)
(合理即可) ![]() (合理即可) 化合
(合理即可) 化合
【解析】
A是人体胃液中帮助消化的物质,则A是盐酸;B可用于改良酸性土壤,则B是氢氧化钙;稀盐酸与氢氧化钙反应生成氯化钙和水,水在通电的条件下生成氢气和氧气,因此C是水,D是氯化钙;稀盐酸能与活泼金属反应生成氢气,故E是氢气,F是氧气;氢氧化钙与氯化钙都能转化为白色沉淀H,故H是碳酸钙,据此解答。
(1)上述物质中属于盐类(由金属离子或铵根离子和酸根离子构成的化合物)的是氯化钙和碳酸钙,其化学式为:CaCl2、CaCO3;
(2) 稀盐酸能与活泼金属反应生成氢气,符合A→E的化学方程式为:![]() (合理即可);氢氧化钙与碳酸钠反应生成碳酸钙的沉淀和氢氧化钠,反应的化学方程式为:
(合理即可);氢氧化钙与碳酸钠反应生成碳酸钙的沉淀和氢氧化钠,反应的化学方程式为:![]() (合理即可)。
(合理即可)。
(3)稀盐酸(A)与氢氧化钙(B)反应生成氯化钙(D)和水(C),以及B、D转化为H均为酸、碱、盐之间发生的反应,属于复分解反应;水(C)在通电的条件下生成氢气(E)和氧气(F),该反应属于分解反应;稀盐酸(A)能与活泼金属反应生成氢气(E),该反应属于置换反应,故上述五个反应中,一定没有发生的基本反应类型是化合反应。

【题目】工业中利用如下反应合成SO3:2SO2+O2![]() 2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
2SO3,一定条件下,在一密闭容器内投入SO2、O2、SO3、V2O5四种物质,在不同时刻测得各物质的质量(单位为克)如下表所示。下列说法不正确的是( )
甲 | 乙 | 丙 | 丁 | |
t1 | 100 | 5 | 80 | 5 |
t2 | 60 | 55 | a | b |
t3 | 40 | c | d | 5 |
A. 丁物质一定是催化剂V2O5
B. 参加反应的SO2分子、O2分子的个数比为2:1
C. 丙物质是O2
D. d=15
【题目】胃酸过多须服用抗酸药物(能与盐酸反应),常用的抗酸药物有碳酸氢钠片、铝碳酸镁片,兴趣小组的同学对这两种药物开展如下探究。
(查阅资料)①铝碳酸镁片的主要成分的化学式为AlMg(OH)3CO3;
②抗酸原理:抗酸药物中的离子和胃酸中的氢离子反应,降低胃液酸性。
活动一:定性探究抗酸药物与“胃酸”的反应。
(1)铝碳酸镁片中含有铝离子、镁离子、氢氧根离子和碳酸根离子。结合上述知识分析,该药物起抗酸作用的微粒是_____(填化学符号)。
(2)小王取一定量碳酸氢钠片与4mLpH═1的稀盐酸(模拟胃酸)反应。药片中其他成分不溶于水也不参加反应。他对反应后溶液的成分产生了兴趣。
(作出猜想)
猜想 1:只含 NaCl;
猜想 2:_____;
猜想 3:NaCl、NaHCO3
(设计实验)
实验步骤 | 实验现象 | 实验结论 | |
实验一 | 取一定量反应后的溶液于试管中,滴加_____ | 无明显现象 | 猜想 3错误 |
实验二 | 另取一定量反应后的溶液于试管中,______ | ______ | 猜想 2正确 |
实验二中涉及反应的化学方程式为______。
活动二:定量探究抗酸药物与“胃酸”的反应,对比分析产生 CO2的速率快慢和中和酸的能力强弱。
如图 1,利用数字化实验分别测定碳酸氢钠片、铝碳酸镁片与“胃酸”反应时,产生 CO2的速率快慢和 pH的变化,得到“二氧化碳浓度与时间”曲线(如图 2)、“pH与时间”曲线(如图 3)。
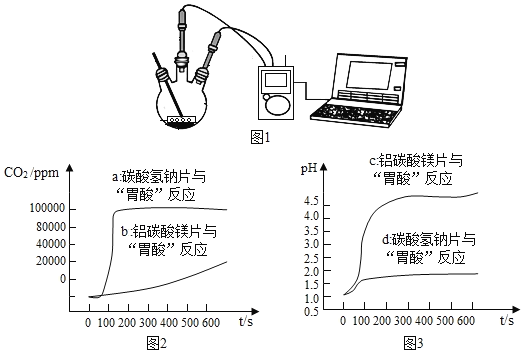
(1)服用碳酸氢钠片更易造成胃胀气,原因是_____。
(2)铝碳酸镁片中和酸的能力更强,理由是_____。
(反思与提升)日常生活中,我们应该根据个人的具体病情,选择合适种类的胃药。