题目内容
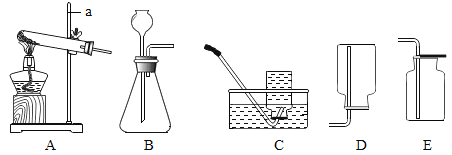
【题目】西西和建设两位同学为探究硫酸的化学性质,做了如下实验:
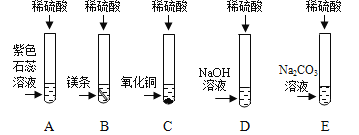
试管 A 中的现象是___________,反应后试管 B 中可能含有的离子是______________(写离子符号);试管 C 中反应的化学方程式__________;建设同学把 D、E 试管内反应后的溶液倒入同一个烧杯中,观察到无明显现象,建设同学认为 D 试管中氢氧化钠溶液和稀硫酸一定恰好完全反应,请评价建设同学的说法___________。
(提出问题)E 试管中反应后溶液中溶质是什么?
猜想一:Na2SO4
猜想二:Na2SO4、H2SO4
西西同学的猜想:_____________(写化学式)
(实验验证)西西同学取少量 E 试管反应后液体于试管中,向其中加入_____________观察到_____________,证明自己的猜想是正确的。结合建设同学的实验,可推知 D 试管溶液中溶质为______________。
(交流总结)在分析某溶液含有的溶质时,可根据与其混合的溶液中(9) ____________及混合后的___________来得出结论。
【答案】紫色石蕊试液变红 H+ ![]() 建设同学的说法不合理 Na2SO4、Na2CO3 稀盐酸 有气泡产生 硫酸钠或硫酸钠、氢氧化钠 溶质成分 实验现象
建设同学的说法不合理 Na2SO4、Na2CO3 稀盐酸 有气泡产生 硫酸钠或硫酸钠、氢氧化钠 溶质成分 实验现象
【解析】
稀硫酸显酸性,能使紫色石蕊试液变红,故实验现象是:紫色石蕊试液变红;
镁与稀硫酸反应生成硫酸镁和氢气,稀硫酸可能过量,故反应后试管 B 中可能含有的离子是:H+;
氧化铜与稀硫酸反应生成硫酸铜和水,该反应的化学方程式为:![]() ;
;
D试管中,氢氧化钠与稀硫酸反应生成硫酸钠和水,E试管中,碳酸钠与稀硫酸反应生成硫酸钠、二氧化碳和水,如果D试管中氢氧化钠过量,E试管中碳酸钠过量,将两者混合后,无明显现象,如果D试管和E试管都是稀硫酸过量,混合后,也无明显现象,只有D试管中稀硫酸过量,E试管中碳酸钠过量时,混合后,才会有气泡产生,故建设同学的说法不合理;
提出问题:碳酸钠与稀硫酸反应生成硫酸钠和水,如果氢氧化钠和稀硫酸恰好完全反应,则溶质是:Na2SO4,如果硫酸过量,则溶质是:Na2SO4、H2SO4,如果碳酸钠过量,则溶质是:Na2SO4、Na2CO3,故西西同学的猜想:Na2SO4、Na2CO3;
实验验证:西西同学的猜想是正确的,故溶质中含有Na2SO4、Na2CO3,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,有气泡产生,故可加入稀盐酸,实验现象是:有气泡产生,故填:稀盐酸、有气泡产生;
E试管中碳酸钠过量,将D、E试管内反应后的溶液倒入同一个烧杯中,观察到无明显现象,碳酸钠能与稀硫酸反应生成硫酸钠、二氧化碳和水,有气泡产生,故D试管中一定不含硫酸,D试管中氢氧化钠与硫酸反应生成硫酸钠和水,可能硫酸和氢氧化钠恰好完全反应,也可能氢氧化钠过量,故D 试管溶液中溶质为:硫酸钠或硫酸钠、氢氧化钠;

【题目】利用下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。
已知:2NH3 + H2SO4 = (NH4)2SO4;(NH4)2SO4为白色固体。
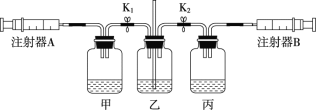
实验步骤 | 实验操作 | 实验现象 |
① | 打开K1,关闭K2,缓慢拉注射器A活塞 | 甲中液面上方无明显现象 |
② | 打开K2,关闭K1,缓慢拉注射器B活塞 | 丙中液面上方出现大量白烟 |
(1)丙中发生化合反应,生成大量白烟(NH4Cl)的化学方程式为________。
(2)该实验能够得出的结论是________。
(3)从微观角度解释甲中无白烟,而丙中出现白烟的原因是__________。
【题目】25°C探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体的质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液的质量分数为10%
B.实验②说明25°C时该物质的溶解度是20g
C.实验③④所得溶液质量分数相同
D.实验④所得溶液中含溶质20g