题目内容
【题目】为了探究金属活动性,将锌和铜分别放入稀硫酸中,铜不反应而锌的表面有气泡产生,写出锌和稀硫酸反应的化学方程式:______。
老师告诉学生,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;猜想二:二氧化硫;猜想三:氢气和二氧化硫的混合物。
(查阅资料)二氧化硫可以使品红溶液褪色,也能被氢氧化钾溶液吸收。浓硫酸只吸收水。
(实验探究)师生设计了如下装置进行实验![]() 部分仪器省略
部分仪器省略![]() ,请完成下列表格。
,请完成下列表格。
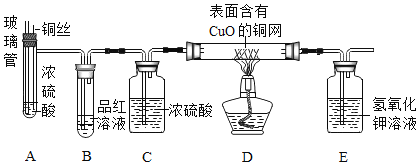
主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是 ______ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想 ______ 正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | | |
④冷却,将A中液体用水稀释 | A中液体变为 ______ 色 | 有硫酸铜生成 |
(表达交流)(1)在步骤③中,鼓入空气的目的是______。
(反思拓展)(2)若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是______,C装置的作用是:______。
(3)下列各组药品能够证明锌的活动性比铜强的是______![]() 填序号
填序号![]() 。
。
①锌、铜、稀盐酸
②锌、硫酸铜溶液
③锌、铜、氯化镁溶液
(1)加热A装置一段时间后,气泡产生的速率由快变慢最后不再产生,请对这一现象进行解释:______。
(2)请尝试写出铜与浓硫酸反应的化学方程式:______。
【答案】Zn+H2SO4═ZnSO4+H2↑ 品红溶液褪色 二 蓝 将装置A中生成的二氧化硫气体全部排出 黑色粉末变成红色,玻璃管内壁有水雾出现 干燥气体 ①② 铜和浓硫酸置于容器中加热会生成二氧化硫,随着反应进行,硫酸溶液中溶质质量分数逐渐减小,而铜不与稀硫酸反应,所以反应最后停止 Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑
CuSO4+2H2O+SO2↑
【解析】
锌与稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
[实验探究]实验得出该反应有二氧化硫生成,根据资料中提供的信息,二氧化硫可以使品红溶液褪色,所以装置B中对应的现象是 品红溶液褪色;装置D玻璃管中装有黑色的氧化铜粉末,在加热的条件下向其中通入气体,无明显现象,说明气体中无氢气,因此只要猜想二正确;A试管中有硫酸铜生成,所以加水稀释后A中液体变为蓝色;
[表达交流](1)在步骤③中,鼓入空气可将将装置A中生成的二氧化硫气体全部排出;浓硫酸具有吸水性,C装置的作用是干燥气体;
[反思拓展](2)装置A中铜丝换成锌片,则锌与稀硫酸反应,生成氢气,装置D玻璃管中的氧化铜被还原,生成单质铜和水,看到的现象是黑色粉末变成红色,玻璃管内壁有水雾出现;
(3)①将锌、铜加入稀盐酸溶液中,锌反应有气泡冒出,铜不反应,无现象,说明铜位于氢的后面,锌位于氢的前面,能证明锌和铜的活动性强弱,故能达到目;②将锌放入硫酸铜溶液中,锌的表面置换出红色的铜,说明锌的活动性比铜强,故能达到目;③将锌和铜分别放入氯化镁溶液中均无明显现象,无法比较锌和铜的金属活动性强弱,故不能达到目;
(4)将足量的铜和浓硫酸置于容器中加热,反应一段时间后,反应会逐渐变慢,最后反应停止,这是因为铜和浓硫酸置于容器中加热会生成二氧化硫,随着反应进行,硫酸溶液中溶质质量分数逐渐减小,而铜不与稀硫酸反应,所以反应最后停止;
(5)铜与浓硫酸共热生成硫酸铜、二氧化硫和水;反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】因二氧化碳能溶于水,并能与水反应生成碳酸,所以二氧化碳一般不用排水法收集。二氧化碳气体究竟能否用排水法收集呢?某化学兴趣小组利用下图所示的两套装置进行了深入地探究。
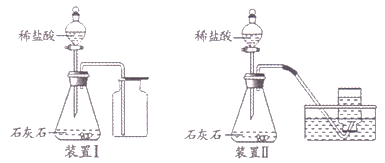
请写出石灰石与稀盐酸反应的化学方程式:______。
(定性实验)实验后,装置Ⅱ水槽中的液体应呈酸性,向此液体中滴加紫色石蕊试液溶液颜色会变为______。但是取几次实验后的液体样品,滴加紫色石蕊试液,均无明显变色现象。对此你认为可能的原因是______。
(定量实验)采用数字化实验测定排水法和向上排空气法收集的二氧化碳纯净度的差异。因实验设备有限,本实验通过氧气传感器测出收集气体中残留的氧气来自于空气),推算出空气的含量,再求出![]() 的含量。请填写下列表格中相应的空白(精确到1%即可):
的含量。请填写下列表格中相应的空白(精确到1%即可):
测得氧气含量 | 推算出 | 结论 | |
排空气法 | 6.6% | 69% | 排水法收集到的二氧化碳更纯净 |
排水法 | 4.2% | ______ |
通过实验可知,若对![]() 纯度要求较高,应该使用排水法收集二氧化碳。
纯度要求较高,应该使用排水法收集二氧化碳。
(实验反思)利用装置Ⅰ和装置Ⅱ收集到的二氧化碳都会混有少量空气,原因是______。
(交流讨论)证明排水法比排空气法所收集的二氧化碳气体纯度更高,还有什么方法?______。
(拓展应用)利用传感器对二氧化碳性质再探究。
步骤1:如图1所示装置的气密性良好,三瓶![]() 的烧瓶内收集满
的烧瓶内收集满![]() 气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。
气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。
步骤2:三位同学同时迅速将注射器内等体积的液体(水、饱和石灰水、氢氧化钠浓溶液)注入各自烧瓶中,关闭活塞。
步骤3:一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图像情况如图2所示。
(查阅资料)氢氧化钙微溶于水,氢氧化钠易溶于水,均可与二氧化碳发生反应。

(1)导致曲线AB段气压增大的主要原因是:______。
(2)图中曲线1中______段气压的变化是由于充分振荡烧瓶导致的。
(3)利用现有的装置,在不使用其他试剂的情况下,请你写出除振荡烧瓶外继续降低E点的操作方法:______。
(4)曲线2与曲线3差异较大的原因是______。
【题目】实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的化学方程式:________________。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
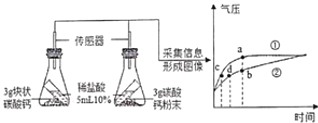
(提出猜想)除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂。(完成实验)按下表进行实验,并测定分解温度(分解温度越低,催化效果越好)。
实验标号 | 实验药品 | 分解温度(℃) |
① | KCI03 | 580 |
② | KCIO3、MnO2(质量比1:1) | 350 |
③ | KClO3、CuO(质量比1:1) | 370 |
④ | KClO3、Fe203(质量比1:1) | 390 |
(分析数据、得出结论)
(1)由实验________与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是________。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后的质量和__________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证。
[提出猜想]质量相同的催化剂,颗粒越细,催化效果越好。
[设计实验]___________________________________________
[结论与反思]颗粒越细,与反应物接触面积越大,催化效果越好。