题目内容
(3分)下图是浓盐酸试剂瓶标签的部分内容。请回答:
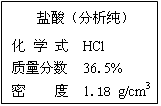
① 欲配制200g溶质质量分数为3.65%的稀盐酸,需要这种浓盐酸 g,体积为 mL。
②用①中所得稀盐酸与足量锌粒反应,请根据化学方程式计算最多可得氢气的质量

① 欲配制200g溶质质量分数为3.65%的稀盐酸,需要这种浓盐酸 g,体积为 mL。
②用①中所得稀盐酸与足量锌粒反应,请根据化学方程式计算最多可得氢气的质量
20 g, 16.9 mL。② 0.2克
①配制200g溶质质量分数为3.65%的稀盐酸的溶质的质量:200×3.65%=7.3g,由标签中浓盐酸的溶质的质量分数36.5%,根据溶质的质量分数=溶质的质量/溶液的质量 ×100%,则:
这种浓盐酸溶液的质量=溶质的质量/溶质的质量分数 ="7.3g" /36.5% =20g,
根据m=ρV,V浓盐酸=m/ρ="20g/" 1.18g/cm3 =16.95cm3=16.9mL;
②由于①计算这种稀盐酸中溶质的质量为7.3g,设最多可得氢气的量为m,根据题意得:
Zn+2HCl=ZnCl2+H2↑
73 2
7.3g m
73 /7.3g ="2" /m m=0.2g
这种浓盐酸溶液的质量=溶质的质量/溶质的质量分数 ="7.3g" /36.5% =20g,
根据m=ρV,V浓盐酸=m/ρ="20g/" 1.18g/cm3 =16.95cm3=16.9mL;
②由于①计算这种稀盐酸中溶质的质量为7.3g,设最多可得氢气的量为m,根据题意得:
Zn+2HCl=ZnCl2+H2↑
73 2
7.3g m
73 /7.3g ="2" /m m=0.2g

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目