题目内容
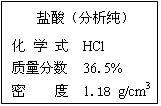
向4支装有质量和质量分数均相同的稀硫酸的试管中,分别加入适量的Mg、MgO、Mg(OH)2、MgCO3,均恰好完全反应,对应得到①②③④四个都不饱和的溶液,则其中溶质质量分数最大的是
| A.① | B.② | C.③ | D.④ |
A
由于是等质量、溶质质量份数相等的稀硫酸分别和适量的四种物质反应,可设稀硫酸中溶质的质量为98克,则:

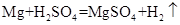
40 98 120 18 24 98 120
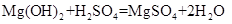

58 98 120 36 84 98 120 18
根据化学方程式不难看出四个反应中生成的硫酸镁的质量是相等的,即所得溶液中溶质的质量相等;而所得溶液中溶剂除了原稀硫酸溶液中的溶剂之外,氧化镁、氢氧化镁、碳酸镁和稀硫酸反应分别生成18克、36克、18克水,而镁和稀硫酸反应没有生成新的水,因此所得溶液中溶质的质量分数由大到小的顺序是Mg>MgO= MgCO3>Mg(OH)2,
故选:A

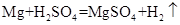
40 98 120 18 24 98 120
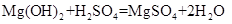

58 98 120 36 84 98 120 18
根据化学方程式不难看出四个反应中生成的硫酸镁的质量是相等的,即所得溶液中溶质的质量相等;而所得溶液中溶剂除了原稀硫酸溶液中的溶剂之外,氧化镁、氢氧化镁、碳酸镁和稀硫酸反应分别生成18克、36克、18克水,而镁和稀硫酸反应没有生成新的水,因此所得溶液中溶质的质量分数由大到小的顺序是Mg>MgO= MgCO3>Mg(OH)2,
故选:A

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目