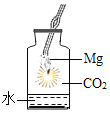
题目内容
【题目】小组同学查资料知道泡沫灭火器原理是:AlCl3+3NaHCO3=3NaCl +Al(OH)3↓+3CO2↑
(提出问题)此反应发生的原因是否由于AlCl3呈酸性?
(实验)测定AlCl3溶液的酸碱性
(1)用__________测定溶液的酸碱性。
(提出问题)NH4Cl溶液呈酸性,它是否也能与NaHCO3溶液反应?
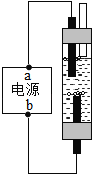
(实验)按下图1进行实验:
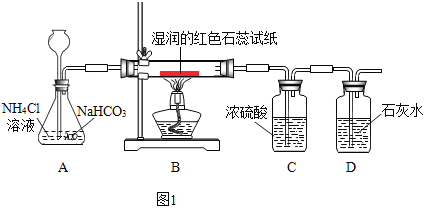
观察到的现象是:湿润的红色石蕊试纸变蓝,石灰水变浑浊
(2)C中浓硫酸的作用是________,D中石灰水的作用是_______。
(3)A中的反应化学方程式是_________。
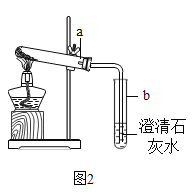
(实验反思)Ⅰ、Na2CO3和 NaHCO3 的性质区别
按图2进行实验:取适量的NaHCO3 粉末加到a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。持续加热直至两试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末。
(4)小文猜测白色固体粉末可能是:①NaOH;②Na2CO3;③NaCl.小燕认为猜想③一定不正确,理由是_______,小燕从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为_________。
(5)他们继续探究固体成分,设计了如下实验:
操作步骤 | 实验现象 | 结论 |
取少量白色固体于试管中,加水溶解,向其中滴加足量_______溶液 | ______ | 剩余的固体有Na2CO3 |
静置,继续滴加酚酞 | 不变红 | 剩余的固体没有NaOH |
通过实验证明: 2NaHCO3 ![]() Na2CO3+ CO2↑ + H2O,NaHCO3热稳定性较Na2CO3差。
Na2CO3+ CO2↑ + H2O,NaHCO3热稳定性较Na2CO3差。
Ⅱ、泡沫灭火器中应用
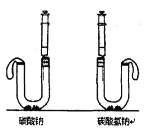
(6)按如图进行实验:U型管中分别加入等质量碳酸钠和碳酸氢钠固体,在两支注射器中分别吸入同溶质质量分数、同体积的足量稀盐酸,然后同时迅速将盐酸分别注入U型管中。____边U型管乳胶套膨胀更大,等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比是____________。
【答案】紫色石蕊溶液 干燥剂 检验是否生成二氧化碳气体 NaHCO3 +NH4Cl=NaCl+ H2O + NH3↑ +CO2↑ NaHCO3中没有氯元素 Na2CO3溶液显碱性,也可以使酚酞变红 CaCl2 有白色成沉淀 右 42:53
【解析】
(1)紫色石蕊试液遇酸性溶液变红色,故填:紫色石蕊试液。
(2)浓硫酸具有吸水性,可用做干燥剂,D中石灰水的作用是检验二氧化碳,故填:干燥剂;检验是否生成二氧化碳气体。
(3)A中氯化铵和碳酸氢钠生成氯化钠氨气和二氧化碳和水,化学方程式为NaHCO3 +NH4Cl=NaCl+ H2O + NH3↑ +CO2↑,故填:NaHCO3 +NH4Cl=NaCl+ H2O + NH3↑ +CO2↑。
(4)小文猜测白色固体粉末可能是:①NaOH;②Na2CO3;③NaCl.其中猜想③一定不正确,理由是NaHCO3中没有氯元素,从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为Na2CO3溶液显碱性,也可以使酚酞变红,故填:NaHCO3中没有氯元素;Na2CO3溶液显碱性,也可以使酚酞变红。
(5)取少量白色固体于试管中,加水溶解,向其中滴加足量氯化钙溶液,有白色沉淀生成,说明剩余的固体有Na2CO3静置,继续滴加酚酞溶液不变红,说明剩余的固体没NaOH,故填:CaCl2;有白色成沉淀。
(6)当碳酸钠和碳酸氢钠质量都为1时,假如完全反应生成二氧化碳质量设为x和y,则:
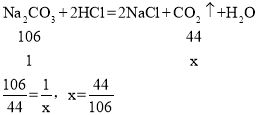
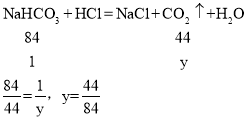 碳酸氢钠生成二氧化碳更多,故右边U型管乳胶套膨胀更大,等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比是
碳酸氢钠生成二氧化碳更多,故右边U型管乳胶套膨胀更大,等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比是![]() ,故填:右:42:53。
,故填:右:42:53。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案