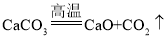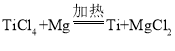题目内容
【题目】19世纪末,科学家瑞利通过如下两种方法制得氮气,并测得其密度,从而获得科学史上的重大发现。请你参与以下的科学发现过程。
方法I:利用空气分离出氮气
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸。 | 通过浓硫酸的 目的是为了除去空气中的_____________。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体) | 请写 出一种能用于除去氧气的物质____________。 |
(3)收集剩余气体,并测定该气体的密度。 | 密度: 1.2572g/L |
方法Ⅱ:用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质(反应装置如下图所示,其中B部分的冰盐起冷凝作用)。测得氮气的密度为1.2508g/L.该反应的化学方程式为_____________________________。
[实验验证]实验小组同学采用方法Ⅱ测定氮气的密度,操作步骤如下:
① 20°C时,经过必要的实验操作后,取含NH4Cl固体0.214g的饱和NH4Cl溶液放入烧瓶,连接装置;
② 调节水准管,使其与量气管中液面相平,记录量气管中水面读数为10.0mL;
③打开分液漏斗的活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯:
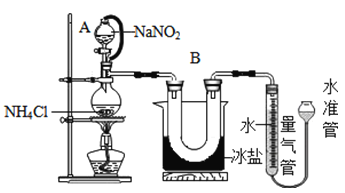
④ 烧瓶中不再产生气泡时,关闭分液漏斗A的活塞;
⑤待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑥处理剩余药品,整理实验台。
[实验分析及数据处理]
(1)步骤①中加入药品前必须进行的实验操作是_________________;
(2)步骤③中移走酒精灯后,实验可持续进行的原因是_________________;
(3)计算该实验中生成的氮气的密度为___________________g/L(保留4位小数)
[解释与结论]瑞利(Rayleigh)发现,采用方法Ⅰ得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大0.5%~ 0.6%。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是________________;(已知:相同条件下,气体的相对分子质量越大,密度就越大)
[反思与评价]
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是____
A 防止NaNO2饱和溶液蒸发
B 保证实验装置不漏气
C 使NaNO2饱和溶液顺利滴下
D 使测得的N2体积更准确
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习和生活中要学习科学家的______________。
A 严谨求实的科学态度和敢于怀疑的批判精神
B 科学研究中遇到疑惑就趁早放弃,不要浪费时间
C 不能因为微小的差异而放过一次成功的机会
D 要相信权威,权威一定是正确的
(3)在实验室中,我们也可将氨气通过炽热的装有氧化铜的硬质玻璃管,生成铜、氮气和水蒸气,该反应的化学方程式为_______________________,若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法__________________ (填“I”或“II”)的更接近。
【答案】水蒸气(或H2O) 铜(或红磷) ![]() 检查装置气密性 NaNO2和NH4CI反应放热,可提供自身反应所需要的温度 1.2444 空气中含有少量密度比氮气大的物质,如稀有气体等没有被除去 CD AC
检查装置气密性 NaNO2和NH4CI反应放热,可提供自身反应所需要的温度 1.2444 空气中含有少量密度比氮气大的物质,如稀有气体等没有被除去 CD AC ![]() Ⅱ
Ⅱ
【解析】
方法I:
(1)将清新洁净的空气通过NaOH溶液可以除去空气中的二氧化碳,浓硫酸具有吸水性,再通过浓硫酸可以除去空气中的水蒸气(或H2O);
(2)除去空气中的氧气,可将气体通过能与氧气反应的物质且产物为固体,例如红磷、铜等,所以实验过程如下表所示:
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸。 | 通过浓硫酸的 目的是为了除去空气中的水蒸气(或H2O)。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体) | 一种能用于除去氧气的物质是铜(或红磷) |
(3)收集剩余气体,并测定该气体的密度。 | 密度: 1.2572g/L |
方法Ⅱ:
用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质,根据质量守恒定律和水的物理性质可知,该液态物质是水,该反应的化学方程式为:![]() ;
;
实验分析及数据处理:
(1)为了实验结果准确,有气体参与的实验,对装置首先进行气密性检查;
(2)酒精灯加热供给反应开始所需的热量后,NaNO2和NH4CI反应放热,可提供自身反应所需要的温度;
(3)生成氮气体积=100mL-10mL=90mL=0.09L;
设生成氮气质量为x。
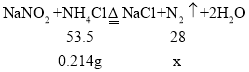
![]() x=0.112g;
x=0.112g;
实验中生成的氮气的密度=![]() ;
;
解释与结论:
根据题目信息,气体相对分子质量越大,气体密度越大,空气中比氮气密度大的气体为二氧化碳和稀有气体,二氧化碳被吸收除去,所以只有稀有气体可以影响氮气的密度的增大。瑞利(Rayleigh)发现,采用方法Ⅰ得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大0.5%~ 0.6%。若实验设计与操作均无错误,且氮气已完全干燥,产生这一现象的原因是空气中含有少量密度比氮气大的物质,如稀有气体等没有被除去;
反思与评价:
(1)连接导管,联通内部的压强,可以保证液体顺利留下,避免压差导致液体流通不畅;避免饱和NaNO2溶液加入烧瓶后,引起的气体体积变化,使测得的N2体积更准确。故选CD;
(2)A、化学学习中要以事实说话,抱有严谨的科学精神,同时对发现的不同现象敢于提出疑问,持有敢于批判的精神,故A正确;
B、缺乏毅力,不能保持刻度求真的态度,不符合学习的精神,故B错误;
C、善于抓住细小,细节决定成败,故C正确;
D、面对疑问要敢于质疑,不得人云亦云,权威不一定正确,故D错误。故选AC。
(3)在实验室中,我们也可将氨气通过炽热的装有氧化铜的硬质玻璃管,生成铜、氮气和水蒸气,该反应的化学方程式为:![]() ;利用化学反应制备氮气,没有稀有气体存在。若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法II的更接近。
;利用化学反应制备氮气,没有稀有气体存在。若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法II的更接近。