题目内容
【题目】CO2是一种宝贵的碳氧资源。
(1)科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环。
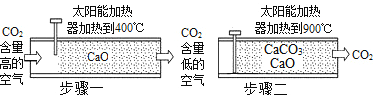
①空气中的氮气的体积分数是________,其中氖气的化学式为________。
②步骤1中能量转化方式是__________能转化为化学能。
③步骤2中发生反应的化学方程式为_________。
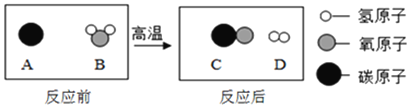
(2)利用CO2催化氢化可制CH4,其实验流程如图:

①铁粉与水蒸气发生置换反应产生氢气的化学方程式是__________。
②点燃CH4前必须进行的操作是________。
(3)实验室常用石灰石与稀盐酸反应制取二氧化碳。为了测定石灰石中碳酸钙的含量,小乐进行了如下实验:取12.0g石灰石放于烧杯中,向烧杯中滴加稀盐酸,实验测得烧杯中剩余物质的质量与加入稀盐酸的质量之间的关系如图所示。整个过程不考虑稀盐酸的挥发和气体的溶解,石灰石中的杂质也不与稀盐酸反应。求:
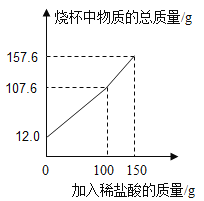
①产生CO2的总质量为___g
②石灰石中碳酸钙的质量分数___(写出计算过程)。
【答案】78% Ne 太阳能 CaCO3![]() CaO+CO2↑ 3Fe+4 H2O(g)
CaO+CO2↑ 3Fe+4 H2O(g)![]() Fe3O4+4H2 验纯 4.4 83.3%
Fe3O4+4H2 验纯 4.4 83.3%
【解析】
(1)①空气中的氮气的体积分数是78%,其中是单原子分子,可以用元素符号直接表示,化学式为:Ne;
②步骤1中能量转化方式是太阳能转化为化学能;
③碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(2)①铁粉与水蒸气反应产生氢气和四氧化三铁,化学方程式是3Fe+4 H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
②点燃CH4前必须进行的操作是验纯,不纯的情况下可能会发生爆炸。
(3)解:根据质量守恒定律可得,生成的二氧化碳的质量为12.0g+150g-157.6g=4.4g,
设石灰石中碳酸钙的质量分数为x,

![]() 解得x=10.0g,
解得x=10.0g,
石灰石中碳酸钙的质量分数![]() 。
。
答:①产生CO2的总质量为4.4g
②石灰石中碳酸钙的质量分数83.3%。

【题目】19世纪末,科学家瑞利通过如下两种方法制得氮气,并测得其密度,从而获得科学史上的重大发现。请你参与以下的科学发现过程。
方法I:利用空气分离出氮气
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸。 | 通过浓硫酸的 目的是为了除去空气中的_____________。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体) | 请写 出一种能用于除去氧气的物质____________。 |
(3)收集剩余气体,并测定该气体的密度。 | 密度: 1.2572g/L |
方法Ⅱ:用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质(反应装置如下图所示,其中B部分的冰盐起冷凝作用)。测得氮气的密度为1.2508g/L.该反应的化学方程式为_____________________________。
[实验验证]实验小组同学采用方法Ⅱ测定氮气的密度,操作步骤如下:
① 20°C时,经过必要的实验操作后,取含NH4Cl固体0.214g的饱和NH4Cl溶液放入烧瓶,连接装置;
② 调节水准管,使其与量气管中液面相平,记录量气管中水面读数为10.0mL;
③打开分液漏斗的活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯:
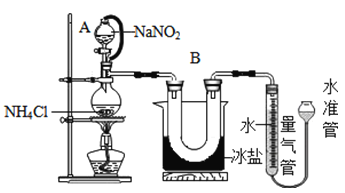
④ 烧瓶中不再产生气泡时,关闭分液漏斗A的活塞;
⑤待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑥处理剩余药品,整理实验台。
[实验分析及数据处理]
(1)步骤①中加入药品前必须进行的实验操作是_________________;
(2)步骤③中移走酒精灯后,实验可持续进行的原因是_________________;
(3)计算该实验中生成的氮气的密度为___________________g/L(保留4位小数)
[解释与结论]瑞利(Rayleigh)发现,采用方法Ⅰ得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大0.5%~ 0.6%。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是________________;(已知:相同条件下,气体的相对分子质量越大,密度就越大)
[反思与评价]
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是____
A 防止NaNO2饱和溶液蒸发
B 保证实验装置不漏气
C 使NaNO2饱和溶液顺利滴下
D 使测得的N2体积更准确
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习和生活中要学习科学家的______________。
A 严谨求实的科学态度和敢于怀疑的批判精神
B 科学研究中遇到疑惑就趁早放弃,不要浪费时间
C 不能因为微小的差异而放过一次成功的机会
D 要相信权威,权威一定是正确的
(3)在实验室中,我们也可将氨气通过炽热的装有氧化铜的硬质玻璃管,生成铜、氮气和水蒸气,该反应的化学方程式为_______________________,若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法__________________ (填“I”或“II”)的更接近。