题目内容
【题目】李明同学对蜡烛及其燃烧进行了探究。按要求填写下列实验现象及其结论。
探究步骤:对实验的观察和描述
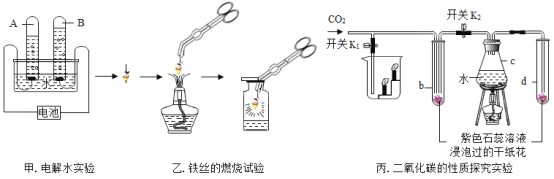
点燃前:石蜡放 入水中观察到的现象___________________________;
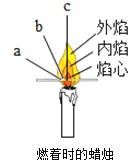
燃着时:①点燃蜡烛,把一根火柴梗放在蜡烛的火焰中,约1s后取出可以看到火柴梗的___________________________(选填图中字母)处最先炭化,说明此处温度最高。
②用干冷的烧杯罩于火焰上方,干冷的烧杯内壁出现__________________现象,澄清的石灰水变浑浊。
熄灭后:吹灭蜡烛, 观察到一缕白烟。
结论:蜡烛燃烧生成____________________和____________________。
提出问题:燃着的蜡烛在刚熄灭时,总会有一缕白烟冒出,白烟的成分是什么呢?
李明同学对此很感兴趣,提出了如下猜想,:并设计实验进行探究。
[猜想与假设]①白烟是蜡烛燃烧时生成的二氧化碳;
②白烟是蜡烛燃烧时生成的水蒸气;
③白烟是石蜡蒸气凝结成的石蜡固体小颗粒。
[实验验证]
(1)熄灭蜡烛,并立即用一个沾有澄清石灰水的烧杯罩住白烟,其目的是为了验证假设是_____________; (填序号, 下同), 此实验 能否得出正确结论? _______________;原因是_______________;
(2)熄灭蜡烛:并立即用一块干而冷的玻璃片放在白烟上,发现玻璃片上没有出现水雾,说明_____________。
(3)熄灭蜡烛,并立即用燃着的木条伸到白烟处(不接触烛芯),发现蜡烛重新点燃,这说明白烟可燃,为假设_____________;提供了证据。同时可排除假设____________,因为_____________。
【答案】浮于水面,难溶于水 a 水珠 水 二氧化碳 ① 否 蜡烛燃烧生成的二氧化碳干扰白烟的检验 白烟不是水蒸气 ③ ① 二氧化碳不能燃烧,也不支持燃烧
【解析】
石蜡放入水中观察到的现象是:石蜡浮在水面上,说明石蜡密度比水小,难溶于水;故填:浮于水面,难溶于水;
①点燃蜡烛,把一根火柴梗放在蜡烛的火焰中,约1s后取可以看到火柴梗的a处最先碳化,说明蜡烛火焰的外焰温度最高;故填:a;
②干冷的烧杯内壁出现水雾,澄清石灰水变浑浊,说明生成物是水和二氧化碳.
故填:水雾。
得出结论:蜡烛燃烧生成二氧化碳和水.
故填:水;二氧化碳;
[实验验证]:
(1)二氧化碳可使澄清石灰水变浑浊,吹灭蜡烛立即用一个沾有澄清石灰水的烧杯罩住白烟,其目的是为了验证假设①;但由于刚吹灭的蜡烛周围尚有残余的其燃烧生成的二氧化碳,所以不能得出正确的结论;
(2)熄灭蜡烛,立即用一块干而冷的玻璃片放在白烟上,玻璃片上没有水雾,说明白烟不是水蒸气;
故答案为:白烟不是水蒸气;
(3)熄灭蜡烛,立即将燃着的木条去点白烟(不要接触烛芯),发现蜡烛重新被点燃,说明白烟具有可燃性,这就证明了假设③的正确性;又因为二氧化碳都不能燃烧,所以同时证明了假设①是不正确的
[实验验证]答案:
(1)①;否;蜡烛燃烧生成的二氧化碳还未完全散去;
(2)白烟不是水蒸气;
(3)③;①;二氧化碳不能燃烧也不支持燃烧.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】19世纪末,科学家瑞利通过如下两种方法制得氮气,并测得其密度,从而获得科学史上的重大发现。请你参与以下的科学发现过程。
方法I:利用空气分离出氮气
实验步骤 | 解释或结论 |
(1)将清新洁净的空气通过NaOH溶液,再通过浓硫酸。 | 通过浓硫酸的 目的是为了除去空气中的_____________。 |
(2)将气体通过能与氧气反应的物质(提示:反应不能生成新的气体) | 请写 出一种能用于除去氧气的物质____________。 |
(3)收集剩余气体,并测定该气体的密度。 | 密度: 1.2572g/L |
方法Ⅱ:用亚硝酸钠(NaNO2)和氯化铵(NH4Cl)反应制取氮气,同时还生成了氯化钠和一种常见的液态物质(反应装置如下图所示,其中B部分的冰盐起冷凝作用)。测得氮气的密度为1.2508g/L.该反应的化学方程式为_____________________________。
[实验验证]实验小组同学采用方法Ⅱ测定氮气的密度,操作步骤如下:
① 20°C时,经过必要的实验操作后,取含NH4Cl固体0.214g的饱和NH4Cl溶液放入烧瓶,连接装置;
② 调节水准管,使其与量气管中液面相平,记录量气管中水面读数为10.0mL;
③打开分液漏斗的活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯:
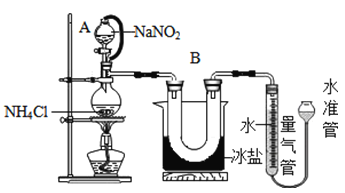
④ 烧瓶中不再产生气泡时,关闭分液漏斗A的活塞;
⑤待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为100.0mL;
⑥处理剩余药品,整理实验台。
[实验分析及数据处理]
(1)步骤①中加入药品前必须进行的实验操作是_________________;
(2)步骤③中移走酒精灯后,实验可持续进行的原因是_________________;
(3)计算该实验中生成的氮气的密度为___________________g/L(保留4位小数)
[解释与结论]瑞利(Rayleigh)发现,采用方法Ⅰ得到的氮气在相同条件下比其他方法得到的纯氮气密度总是偏大0.5%~ 0.6%。若实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因是________________;(已知:相同条件下,气体的相对分子质量越大,密度就越大)
[反思与评价]
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是____
A 防止NaNO2饱和溶液蒸发
B 保证实验装置不漏气
C 使NaNO2饱和溶液顺利滴下
D 使测得的N2体积更准确
(2)科学家瑞利仅仅是从小数点第三位数的差别,发现了新物质。这启示我们在今后的学习和生活中要学习科学家的______________。
A 严谨求实的科学态度和敢于怀疑的批判精神
B 科学研究中遇到疑惑就趁早放弃,不要浪费时间
C 不能因为微小的差异而放过一次成功的机会
D 要相信权威,权威一定是正确的
(3)在实验室中,我们也可将氨气通过炽热的装有氧化铜的硬质玻璃管,生成铜、氮气和水蒸气,该反应的化学方程式为_______________________,若实验操作正确,除去水蒸气,经过精确测定,用该方法测得的氮气密度数值应与上述方法__________________ (填“I”或“II”)的更接近。