题目内容
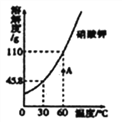
【题目】向盛有一定质量稀盐酸的烧杯中逐渐加入石灰石,产生气体质量与石灰石质量的关系如图所示。恰好完全反应后称的烧杯中剩余物质的质量为108.1g,根据关系图分析并计算:
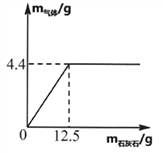
(1)稀盐酸完全反应时,产生CO2气体的物质的量为______________。
(2)该稀盐酸溶质的质量分数为________________。(写出计算过程)。
【答案】 0.1mol 7.3%
【解析】(1)由图可知,生成二氧化碳的质量为4.4g,故二氧化碳的物质的量是4.4g![]() g/mol=0.1 mol;
g/mol=0.1 mol;
(2)设生成4.4g的二氧化碳需要盐酸的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
73 44
x 4.4g
![]() =
=![]() 求得x=7.3g
求得x=7.3g
反应前稀盐酸的质量为108.1g+4.4g-12.5g=100g
稀盐酸中溶质的质量分数为![]() =7.3%。
=7.3%。
答;产生CO2气体的物质的量为0.1 mol; 稀盐酸中溶质的质量分数为7.3%。

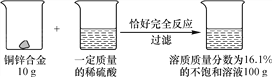
【题目】小华想测定Cu—Zn合金中铜的质量分数,实验室只提供了一瓶稀盐酸和相关的仪器。为了测定该合金的组成,小华称取10克该合金粉末,在粉末中连续三次加入稀盐酸反应。每加一次盐酸,小华记录所得气体的质量,实验数据如下:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积(ml) | 10 | 10 | 10 |
生成氢气的质量(g) | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10克合金粉末总共收集到___________克氢气。
(2)求出该合金中铜的质量分数为_________。(提示:Cu不与稀盐酸反应,锌与稀盐酸反应的化学方程式为Zn+2HCl=ZnCl2+H2↑)
【题目】实验室有一瓶标签残缺并且瓶盖没有完全密封的无色溶液(如右图),为确认其中的溶质,同学们进行了如下的探究活动。请你参与到其中去,回答有关问题。

【进行猜想】猜想Ⅰ:该溶液的溶质是NaCl;
猜想Ⅱ:该溶液的溶质是NaOH;
猜想Ⅲ:该溶液的溶质是Na2CO3;
猜想IV:该溶液的溶质是NaHCO3.
【查阅资料】常温下物质的相关信息如下表:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
从物质的相关信息可知,该溶液的溶质不是NaHCO3,因为常温下NaHCO3溶液溶质的质量分数最大是
(精确到01.%)。
【进行实验】
(1)测定溶液的pH大于7,该溶液的溶质不是 (填化学式)。
(2)同学们又进行了如下实验,实验过程如下:

①产生白色沉淀的化学方程式是 。
②实验可以判断原无色溶液中含有的溶质有 。
【获得结论】
该瓶原来装的无色溶液的溶质是NaOH,并且 (填“没有”、“部分”或“全部”)变质。
【拓展】
提纯该无色溶液的步骤是:先向无色溶液中加入适量的 ,然后过滤。反应化学方程式是 。