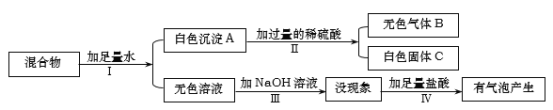
题目内容
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:
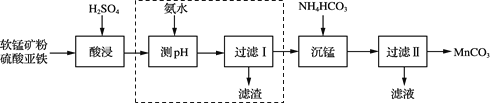
已知“沉锰”反应为MnSO4+2NH4HCO3===(NH4)2SO4+MnCO3↓+H2O+CO2↑
(1)“酸浸”时发生的主要反应为2FeSO4+MnO2+2H2SO4===X+MnSO4 +2H2O,X的化学式为______;“酸浸”时还发生的反应有______(任写一个化学方程式)。
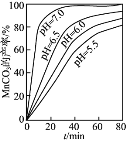
(2)流程中虚线内工序的主要目的是______。“沉锰”工序中,如图为MnCO3的产率与溶液pH、反应时间t的关系,由图可知应控制溶液的pH 为______。
(3)“过滤Ⅱ”后续的操作为洗涤、干燥,证明MnCO3固体已经洗涤干净的操作是______。
【答案】Fe2(SO4)3 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 或 Al2O3+3H2SO4=Al2(SO4)3+3H2O 将Fe3+和Al3+转化为沉淀而除去 7.0 取最后一次洗涤液,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀产生,说明已经洗涤干净。
【解析】
(1)由于软锰矿粉(主要含MnO2,还有少量Fe2O3),所以“酸浸”时发生的反应是氧化铁和硫酸反应生成硫酸铁和水,以及硫酸亚铁和二氧化锰以及硫酸反应生成硫酸铁和硫酸镁以及水,对应的化学方程式为:2FeSO4+MnO2+2H2SO4=Fe2(SO4)3+MnSO4+2H2O和 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
故填:Fe2(SO4)3;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)流程中虚线内价氨水的是调节溶液的PH,主要目的是将Fe3+和Al3+转化为沉淀而除去。“沉锰”工序中,如图当PH=7.0时, MnCO3的产率最高。
故填:将Fe3+和Al3+转化为沉淀而除去;7.0;
(3)“过滤Ⅱ”后续的操作为洗涤、干燥,证明MnCO3固体已经洗涤干净的操作是取最后一次洗涤液,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀产生,说明已经洗涤干净。
故填:取最后一次洗涤液,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀产生,说明已经洗涤干净。
。