题目内容
【题目】核电荷数为1-18的元素的原子结构示意图信息如下。
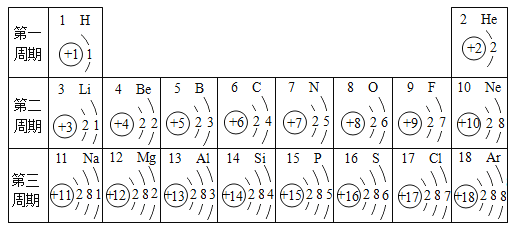
(1)氧、硫元素位于同一纵行的原因是_______ ,它们在化学反应中易_______ (填“得到”或“失去”)电子。
(2)M2+与Ne原子具有相同的核外电子排布,M元素的名称是_______ 。
(3)同一周期,从左到右,各元素原子的_______依次增加。
【答案】最外层电子数 失去 镁 最外层电子数
【解析】
(1)氧、硫元素位于同一纵行,是因为它们原子的最外层电子数相同;它们的最外层电子数均是6,均在化学反应中易得到2个电子而形成阴离子;
(2)M2+与Ne原子具有相同的核外电子排布,是原子失去2个电子得到的,其原子的最外层电子数为12,则其核内质子数为12,为镁元素;
(3)同一周期从左到右,各元素原子的最外层电子数依次递增。

练习册系列答案
相关题目
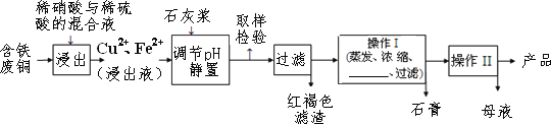
【题目】硫酸铜是一种应用极其广泛的化工原料,易溶于水而不易溶于酒精;以下是某工厂用含铁废铜为原料生产胆矾(CuSO4·5H 2O)和副产物石膏(CaSO4·2H 2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g 水)如表。
温度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是_________;
(2)含铁的废铜和稀硫酸反应的化学方程式_____
(3)操作 I 最后温度应该控制在_____℃左右;
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为蒸发浓缩、_____、过滤、洗涤、干燥;晶体用无水乙醇作洗涤液而不用蒸馏水的原因是_____。