题目内容
(11)请你和小明一起进行实验室制取二氧化碳和二氧化碳的性质探究实验.
(1)确定药品.小明对3组药品进行了研究,实验记录如下:
从制取和收集的角度分析,一般选择第①组药品,该组药品发生反应的符号表达式为 。
不选择第③组药品的原因是 。
反应速率太快,难以控制,难以收集
(2)检查仪器药品:下面是实验桌上摆放好的该实验所需的用品,小明发现其中缺少了一种必需的实验仪器和一种药品,请你写出所缺仪器的名称 ,镊子、所缺药品是 。

(3)选择装置.通过对制取二氧化碳反应的分析,他选择用过氧化氢制取氧气的发生装置.你认为他选择的依据是 。
若要得想到平稳的气流,你认为他最好改用的发生装置是 (下图)A(选填“A”或“B”)

若用C装置收集生成的二氧化碳,气体应从 进入浓硫酸a
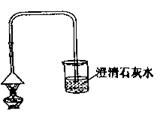
(4)制取气体.将药品装入所选装置制取气体,并用向上排空气法收集.验满方法是 。
将燃着的木条放在集气瓶口,观察火焰是否熄灭
(5)气体检验.将生成的气体通入石灰水中,石灰水不浑浊.可能的原因是 。
(6)清洗整理.小明发现此时试管中石灰石表面的还在产生气泡.他认为该废液可能具有 性,所以不能倒入下水道,应该倒入 中。酸性
(1)确定药品.小明对3组药品进行了研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快,形成大量泡沫从导管冲出 |
不选择第③组药品的原因是 。
反应速率太快,难以控制,难以收集
(2)检查仪器药品:下面是实验桌上摆放好的该实验所需的用品,小明发现其中缺少了一种必需的实验仪器和一种药品,请你写出所缺仪器的名称 ,镊子、所缺药品是 。

(3)选择装置.通过对制取二氧化碳反应的分析,他选择用过氧化氢制取氧气的发生装置.你认为他选择的依据是 。
若要得想到平稳的气流,你认为他最好改用的发生装置是 (下图)A(选填“A”或“B”)

若用C装置收集生成的二氧化碳,气体应从 进入浓硫酸a
(4)制取气体.将药品装入所选装置制取气体,并用向上排空气法收集.验满方法是 。
将燃着的木条放在集气瓶口,观察火焰是否熄灭
(5)气体检验.将生成的气体通入石灰水中,石灰水不浑浊.可能的原因是 。
(6)清洗整理.小明发现此时试管中石灰石表面的还在产生气泡.他认为该废液可能具有 性,所以不能倒入下水道,应该倒入 中。酸性
(1) 略 ;反应的速度太快。
(2) 镊子; 稀盐酸。
(3)都是固液反应且不需要加热 ;A; a
(4)将燃烧的木条靠近瓶口看是否熄灭 ;
(5)盐酸的浓度偏大 ;
(6) 腐蚀;指定的容器内;
(2) 镊子; 稀盐酸。
(3)都是固液反应且不需要加热 ;A; a
(4)将燃烧的木条靠近瓶口看是否熄灭 ;
(5)盐酸的浓度偏大 ;
(6) 腐蚀;指定的容器内;
试题分析:(1)稀硫酸与石灰石反应生成难溶的硫酸钙覆盖在石灰石表面阻止反应继续发生,碳酸钠粉末与稀盐酸反应速度太快来不及收集,故选第①组药品;
(2)给出的药品中少了稀盐酸,仪器中少了镊子
(3)制取二氧化碳的药品是固体与液体,反应条件是常温,和双氧水制氧气的反应物状态和反应条件是相同的,故选择的发生装置应相同.要想得到平稳气需控制双氧水的滴加速度,若要得到干燥的二氧化碳需用浓硫酸吸收水分,二氧化碳密度比空气大,需从a端进入;
(4)学会区别二氧化碳和氧气的验满方法.将燃着的木条放在集气瓶口,观察火焰是否熄灭
(5)气体检验.将生成的气体通入石灰水中,石灰水不浑浊,说明二氧化碳气体中含有能与氢氧化钙反应的其它气体,只能是盐酸挥发出的氯化氢,故可能原因所用盐酸浓度太大,制得二氧化碳中含有HCl 气体.
(6)检验酸性的方法:根据酸的化学性质,酸性溶液能使紫色石蕊变红,pH小于7,能与金属反应生成氢气,能与碳酸盐反应生成二氧化碳气体等.
点评:二氧化碳的实验室制法:固+液,不需加热;反应原理、发生装置和收集装置用到的仪器,以及其检验和验满的方法和操作.学会用探究的方法研究实验问题.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目


 生石灰
生石灰 石灰水
石灰水 碳酸钙
碳酸钙