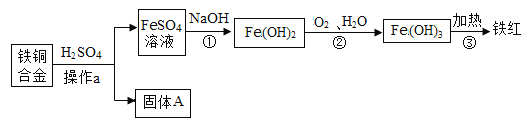
题目内容
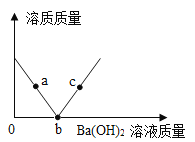
【题目】25°C时,向25.0mL质量分数为30%的盐酸中滴加氢氧化钠溶液,溶液的pH与所加氢氧化钠溶液的体积如图所示。下列说法正确的是
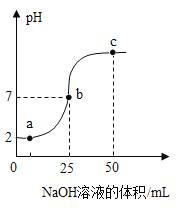
A.a点所示的溶液中含有的溶质是NaOH和NaCl
B.b点所示的溶液能使紫色石蕊溶液变红
C.所用氢氧化钠溶液的质量分数一定为30%
D.a、b、c所示的溶液中都含有Na+、Cl-
【答案】D
【解析】
A、向盐酸中滴加氢氧化钠溶液,氢氧化钠与盐酸反应生成氯化钠和水,a点时,pH<7,说明盐酸未完全反应,故a点所示的溶液中含有的溶质是:NaCl、HCl,不符合题意;
B、b点所示的溶液,pH=7,溶液显中性,不能使紫色石蕊试液变色,不符合题意;
C、当滴加氢氧化钠溶液的体积为25mL时,pH=7,但是氢氧化钠和稀盐酸的密度不一定相同,所用氢氧化钠溶液的质量分数不一定为30%,不符合题意;
D、氢氧化钠与稀盐酸反应生成氯化钠和水,a、b、c所示的溶液中溶质都有氯化钠,故都含有Na+、Cl-,符合题意。
故选D。

【题目】老师带领同学们探究铝和稀盐酸、稀硫酸的反应时发现:铝和稀盐酸剧烈反应,而和稀硫酸几乎不反应。
写出铝和稀盐酸反应的化学方程式_____。
[提出问题]铝和稀硫酸为什么几乎不反应?
[猜想与假设]猜想1:稀盐酸和稀硫酸中的氢离子浓度不同;
猜想2:盐酸中的氯离子对反应起了促进作用;
猜想3:硫酸中的硫酸根离子对反应起了阻碍作用。
[进行实验]
实验序号 | 实验操作 | 实验现象 | 实验结论 |
① | _____ | _____ | 猜想1错误 |
② | 在两支试管中各加入5 mL氢离子浓度相等的稀硫酸,分别插入规格相同的打磨的铝丝。 向其中一支试管中加入1g NaCl晶体 | _____ | 猜想2正确; 猜想3错误 |
[实验反思]
有同学用浓盐酸代替氯化钠证明猜想2正确,他的错误之处是_____。
[实验解释]老师带领同学们利用数字化手持技术探究金属铝和稀盐酸反应时容器内压强和温度随时间变化的关系(如图)。
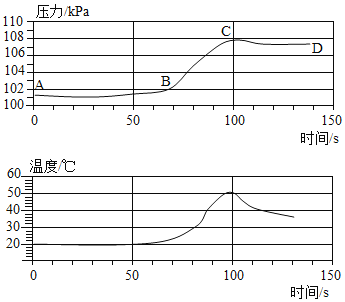
由图可知,_____(填字母序号)点时铝和稀盐酸反应完全。
(1) 0~50s内AB段压强变化不明显,原因可能是_____。
(2) BC段压强明显上升的主要原因是_____。
(3) CD段压强下降的原因是_____。