题目内容
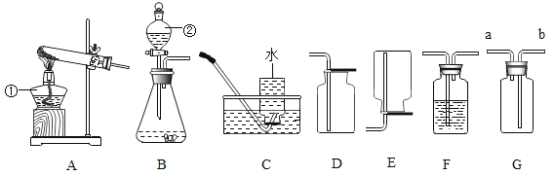
【题目】某同学进行如图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合再充分反应后过滤,结果得到滤渣A和无色滤液B。
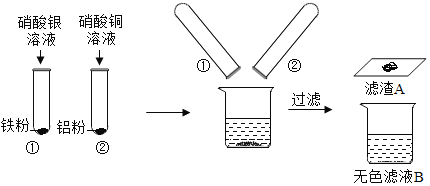
(1)试管①中反应的化学方程式为:_______________________________________;试管②中观察到的现象是:有红色固体出现,溶液____________________。
(2)过滤操作中需要的玻璃仪器有:烧杯、玻璃棒和__________
【答案】Fe + 2AgNO3= 2Ag + Fe(NO3)2 由蓝色变为无色 漏斗
【解析】
(1)金属活动性铝>铁>铜>银,所以铁和能与硝酸银反应生成硝酸亚铁和银,铝和能与硝酸铜反应生成硝酸铝和铜;硫酸铜溶液显蓝色,硝酸亚铁溶液显浅绿色,硫酸铝溶液为无色溶液。
(1)试管①中,铁和硝酸银反应生成硝酸亚铁和银,反应的化学方程式为:Fe+2AgNO3=Fe(NO3)2+2Ag;
试管②中铝和硝酸铜反应生成硝酸铝和铜,观察到的现象是:有红色固体出现,溶液由蓝色变成无色。
故填:Fe+2AgNO3=Fe(NO3)2+2Ag;由蓝色变成无色。
(2)过滤操作中需要的玻璃仪器有:烧杯、玻璃棒和漏斗;
故填:漏斗。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某化学学习小组在老师的指导下,对白色粉笔的成分进行探究。
(提出问题)白色粉笔的主要成分是什么呢?老师提示是一种常见的钙盐与少量性质稳定的粘合剂制成的。
(猜想与假设)同学分别做出如下猜想:
A:碳酸钙 B:氢氧化钙 C:硫酸钙 D:氯化钙 E:硝酸钙
同学们根据老师提示并讨论,立即否定了B的猜想,你认为理由是______。
(查阅资料)
(1)硫酸钙是自然界中石膏矿的主要成分,为白色固体,微溶于水。
(2)室温下几种物质的溶解度
物质 | 碳酸钙 | 氯化钙 | 硫酸钙 | 硝酸钙 |
溶解度/g | 0.0013 | 74.5 | 0.3 | 138 |
(进行实验)
实验操作 | 现象 | 结论 | |
① | 取少量白色粉笔研碎于试管中,加入 ______ | 无现象 | A不成立 |
② | 取少量白色粉笔研碎于烧杯中,加入少量水,搅拌 | 固体没有明显减少 | ______ 不成立 |
③ | 将②进行 ______ 操作,得到清液A和固体,向清液中加入 ______ 溶液,再加入足量稀盐酸 | 产生白色沉淀,沉淀不消失 | C成立 |
请写出③中发生反应的化学方程式______。
注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。
(拓展延伸)为了测定生石膏的组成(CaSO4xH2O),即测定x的值,做了如下实验:将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下,并利用数据绘制的图象如图所示。
查阅资料:含结晶水的硫酸钙有两种组成形式,在加热过程中,分步失去结晶水,最终得到硫酸钙固体。
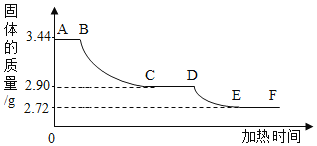
实验顺序 (按序延长加热时间) | 固体质量/g | |
加热前 | 加热后 | |
1 | 3.44 | 3.26 |
2 | 3.44 | 3.12 |
3 | 3.44 | 2.90 |
4 | 3.44 | 2.90 |
5 | 3.44 | 2.80 |
6 | 3.44 | 2.78 |
7 | 3.44 | 2.72 |
8 | 3.44 | 2.72 |
(1)AB段固体质量不变的原因______。
(2)利用实验数据,计算x=______。
(3)图中CD段固体物质的化学式______。
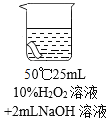
【题目】彩漂洗衣液能够去渍、除菌,白色和彩色织物均可使用。彩漂洗衣液中含有过氧化氢。实验小组对过氧化氢的某些性质进行探究。

[使用说明]每2L水加入1瓶盖本品,与洗衣粉混合浸泡效果更佳;遇顽固污渍,可适当提高水温或延长浸泡时间。注意:使用彩漂液清洗彩色衣服时水温不宜超过50°C!
[进行实验]探究过氧化氢溶液的漂白性。
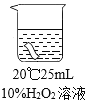
实验1:室温下用10%的过氧化氢溶液浸泡一块红色布条,浸泡时间与布条颜色变化如下表。
浸泡时间 | 20分钟 | 40分钟 | 60分钟 |
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色明显变浅 |
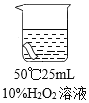
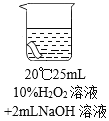
实验2:将红色布条分别浸泡在4种溶液中,20 分钟后现象如下表。
编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色稍变浅 | 颜色明显变浅 |
[解释与结论]
(1)实验1的目的是探究_____________对H2O2溶液漂白效果的影响。
(2)实验2中,欲得出“其他条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,需要对比实验______________
(3) 实验2中,通过对比②④,得出的结论是__________。
(4)根据上述实验,推测“使用彩漂液清洗彩色衣服时水温不宜超过50°C”的原因是________。
[注意:若答对第(5) (6) 小题奖励4分,化学试卷总分不超过60分。]
实验小组查得知,FeCl2 溶液对过氧化氢溶液分解有催化效果,在老师的指导下设计以下实验:向两支试管中分别加入等质量不同浓度(5%和2%)的H2O2溶液,再同时用注射器匀速注入等质量、等浓度的FeCl3溶液,分别用气压传感器测定(装置气密性良好)两试管中气体压力的变化曲线如图所示:
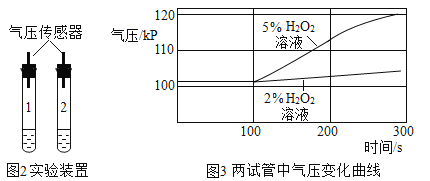
(5)图2中0-100秒管内气压几乎没有变化的可能原因是________;请你再从图2曲线中找FeCl3溶液对H2O2溶液分解影响的一条规律性结论:_______。
(6)请设计实验证明是FeCl3溶液中的Fe3+ 对过氧化氢溶液分解有催化效果:_______(包括实验步骤和预期现象)