题目内容
【题目】彩漂洗衣液能够去渍、除菌,白色和彩色织物均可使用。彩漂洗衣液中含有过氧化氢。实验小组对过氧化氢的某些性质进行探究。

[使用说明]每2L水加入1瓶盖本品,与洗衣粉混合浸泡效果更佳;遇顽固污渍,可适当提高水温或延长浸泡时间。注意:使用彩漂液清洗彩色衣服时水温不宜超过50°C!
[进行实验]探究过氧化氢溶液的漂白性。
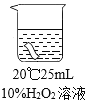
实验1:室温下用10%的过氧化氢溶液浸泡一块红色布条,浸泡时间与布条颜色变化如下表。
浸泡时间 | 20分钟 | 40分钟 | 60分钟 |
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色明显变浅 |
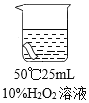
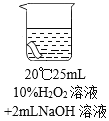
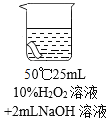
实验2:将红色布条分别浸泡在4种溶液中,20 分钟后现象如下表。
编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色稍变浅 | 颜色明显变浅 |
[解释与结论]
(1)实验1的目的是探究_____________对H2O2溶液漂白效果的影响。
(2)实验2中,欲得出“其他条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,需要对比实验______________
(3) 实验2中,通过对比②④,得出的结论是__________。
(4)根据上述实验,推测“使用彩漂液清洗彩色衣服时水温不宜超过50°C”的原因是________。
[注意:若答对第(5) (6) 小题奖励4分,化学试卷总分不超过60分。]
实验小组查得知,FeCl2 溶液对过氧化氢溶液分解有催化效果,在老师的指导下设计以下实验:向两支试管中分别加入等质量不同浓度(5%和2%)的H2O2溶液,再同时用注射器匀速注入等质量、等浓度的FeCl3溶液,分别用气压传感器测定(装置气密性良好)两试管中气体压力的变化曲线如图所示:
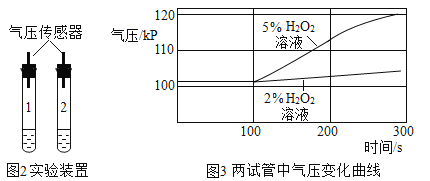
(5)图2中0-100秒管内气压几乎没有变化的可能原因是________;请你再从图2曲线中找FeCl3溶液对H2O2溶液分解影响的一条规律性结论:_______。
(6)请设计实验证明是FeCl3溶液中的Fe3+ 对过氧化氢溶液分解有催化效果:_______(包括实验步骤和预期现象)
【答案】浸泡时间 ①②或③④ 氢氧化钠溶液能够增强H2O2溶液的漂白效果 水温超过50℃时,H2O2溶液漂白效果明显增强,会使衣物褪色 氯化铁溶液没有和过氧化氢溶液充分混合,过氧化氢分解速率较慢 过氧化氢浓度越大,氯化铁的催化效率越高 实验步骤:取等浓度、等体积的过氧化氢溶液于两支试管中,分别同时滴加等浓度、等体积的氯化钠溶液、氯化铁溶液;
实验现象:滴加氯化铁溶液的试管产生气泡速率比滴加氯化钠溶液的试管快
【解析】
(1)实验1的目的是探究浸泡时间对H2O2溶液漂白效果的影响。
故填:浸泡时间。
(2)实验2中,欲得出“其他条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,需要只有温度不同,控制其他条件都不变,需要对比实验①②或③④。
故填:①②或③④。
(3)实验2中,通过对比②④,得出的结论是氢氧化钠溶液能够增强H2O2溶液的漂白效果。
故填:氢氧化钠溶液能够增强H2O2溶液的漂白效果。
(4)根据上述实验,推测“使用彩漂液清洗彩色衣服时水温不宜超过50℃”的原因:水温超过50℃时,H2O2溶液漂白效果明显增强,会使衣物褪色。
故填:水温超过50℃时,H2O2溶液漂白效果明显增强,会使衣物褪色。
(5)图3中0-100秒管内气压几乎没有变化的可能原因:氯化铁溶液没有和过氧化氢溶液充分混合,过氧化氢分解速率较慢;
从图3曲线中可知,过氧化氢浓度越大,氯化铁的催化效率越高。
故填:氯化铁溶液没有和过氧化氢溶液充分混合,过氧化氢分解速率较慢;过氧化氢浓度越大,氯化铁的催化效率越高。
(6)实验方案:实验步骤:取等浓度、等体积的过氧化氢溶液于两支试管中,分别同时滴加等浓度、等体积的氯化钠溶液、氯化铁溶液;
实验现象:滴加氯化铁溶液的试管产生气泡速率比滴加氯化钠溶液的试管快;
实验结论:是FeC13溶液中的Fe3+对过氧化氢溶液分解有催化效果。
故填:实验步骤:取等浓度、等体积的过氧化氢溶液于两支试管中,分别同时滴加等浓度、等体积的氯化钠溶液、氯化铁溶液;
实验现象:滴加氯化铁溶液的试管产生气泡速率比滴加氯化钠溶液的试管快。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
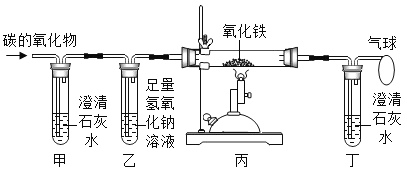
轻松课堂标准练系列答案【题目】某班同学为验证碳酸钠的化学性质,向盛有碳酸钠的试管中加入一定量的稀盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图所示)。请回答问题:
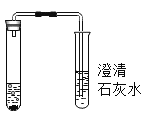
(1)右侧试管中澄清石灰水变浑浊的化学反应方程式为________。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中,充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响) :
[提出问题]
废液中溶质的成分是什么?
[做出猜想]
猜想一: CaCl2、NaCl和HCl
猜想二: CaCl2、NaCl和Na2CO3
猜想三:______;
[进行讨论]
经过讨论,同学们一致认为猜想________是错误的。
[设计实验]
甲同学取少量废液于试管中,向其中加入硝酸银溶液,观察到白色沉淀,甲同学得出实验结论:猜想一正确。请你评价甲同学的实验及结论________。
请帮助乙同学完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_________溶液 | 溶液中先产生气泡,后产生白色沉淀 | 猜想一成立 |
[反思拓展]
最终同学们确认了废液中溶质的成分。若将废液直接排入铸铁管道,危害是_______,可以加入过量的______(写化学式)处理废液,使之达到中性后排放。
【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】首届中国国际钢铁流通博览会以“困境与出路”为主题,将发展网上钢贸交易平台,钢材条形码有价格、产地等信息。则:
(1)生铁和钢是_____不同的两种铁合金,都属于_____(填“纯净物”或“混合物”)。
(2)为了探究铁与锰的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中的Mn元素显+2价)。请回答:
金属 | 铁 | 锰 |
分别与盐酸反应的现象 | 放出气泡速率缓慢 | 放出气泡速率较快 |
得出结论 | 得出活动性:铁_____(填“>”“<”)锰 | |
(3)写出锰与稀盐酸发生反应的化学方程式为____________,该反应的基本类型为____。