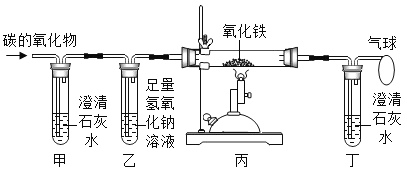
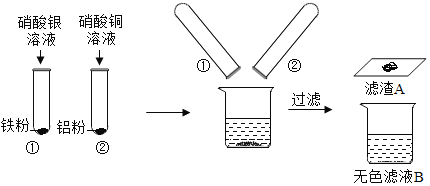
题目内容
【题目】某化学学习小组在老师的指导下,对白色粉笔的成分进行探究。
(提出问题)白色粉笔的主要成分是什么呢?老师提示是一种常见的钙盐与少量性质稳定的粘合剂制成的。
(猜想与假设)同学分别做出如下猜想:
A:碳酸钙 B:氢氧化钙 C:硫酸钙 D:氯化钙 E:硝酸钙
同学们根据老师提示并讨论,立即否定了B的猜想,你认为理由是______。
(查阅资料)
(1)硫酸钙是自然界中石膏矿的主要成分,为白色固体,微溶于水。
(2)室温下几种物质的溶解度
物质 | 碳酸钙 | 氯化钙 | 硫酸钙 | 硝酸钙 |
溶解度/g | 0.0013 | 74.5 | 0.3 | 138 |
(进行实验)
实验操作 | 现象 | 结论 | |
① | 取少量白色粉笔研碎于试管中,加入 ______ | 无现象 | A不成立 |
② | 取少量白色粉笔研碎于烧杯中,加入少量水,搅拌 | 固体没有明显减少 | ______ 不成立 |
③ | 将②进行 ______ 操作,得到清液A和固体,向清液中加入 ______ 溶液,再加入足量稀盐酸 | 产生白色沉淀,沉淀不消失 | C成立 |
请写出③中发生反应的化学方程式______。
注意:若答对以下问题可奖励4分,化学试卷总分不超过60分。
(拓展延伸)为了测定生石膏的组成(CaSO4xH2O),即测定x的值,做了如下实验:将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下,并利用数据绘制的图象如图所示。
查阅资料:含结晶水的硫酸钙有两种组成形式,在加热过程中,分步失去结晶水,最终得到硫酸钙固体。
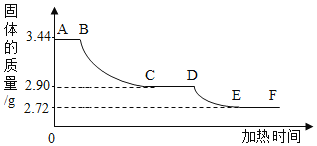
实验顺序 (按序延长加热时间) | 固体质量/g | |
加热前 | 加热后 | |
1 | 3.44 | 3.26 |
2 | 3.44 | 3.12 |
3 | 3.44 | 2.90 |
4 | 3.44 | 2.90 |
5 | 3.44 | 2.80 |
6 | 3.44 | 2.78 |
7 | 3.44 | 2.72 |
8 | 3.44 | 2.72 |
(1)AB段固体质量不变的原因______。
(2)利用实验数据,计算x=______。
(3)图中CD段固体物质的化学式______。
【答案】氢氧化钙是碱而不是盐 稀盐酸 DE 过滤 氯化钡 CaSO4+BaCl2=BaSO4↓+CaCl2 未达到分解温度 2 2CaSO4H2O
【解析】
[猜想与假设]老师提示是一种常见的钙盐,氢氧化钙是碱而不是盐,B的猜想错误;
[进行实验]①取少量白色粉笔研碎于试管中,加入稀盐酸,无现象,说明无碳酸钙,A不成立;
②氯化钙、硝酸钙易溶于水,取少量白色粉笔研碎于烧杯中,加入足量水,搅拌,固体没有明显减少,说明无氯化钙、硝酸钙,DE不成立;
③将②进行过滤,得到清夜A和固体,向清液中加入氯化钡溶液,再加入足量稀盐酸,产生白色沉淀,沉淀不消失,说明有硫酸钙,丙成立;
硫酸钙与氯化钡反应产生硫酸钡沉淀和氯化钙,发生反应的化学方程式为:CaSO4+BaCl2=CaCl2+BaSO4↓;
[拓展延伸](1)生石膏分解需要一定的温度,AB段固体质量不变的原因未达到分解温度;
(2)石膏加热分解减少的质量就是水的质量,由实验数据知3.44gCaSO4xH2O完全分解得到无水CaSO42.72g,则:

![]() ,
,
x=2,所以石膏的化学式为CaSO42H2O;
(3)由实验数据知在A-B段时石膏的质量为2.90g,其中CaSO42.72g,H2O0.18g。此时其化学式可表示为2CaSO4H2O。

 名校课堂系列答案
名校课堂系列答案【题目】氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙![]() 遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的
遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的![]() 加入
加入![]() 溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。
(提出问题)滤液中溶质的成分是什么?
猜想一:NaOH猜想二:NaOH、![]()
猜想三:NaOH、![]() 猜想四:NaOH、
猜想四:NaOH、![]() 、
、![]()
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因______。
(实验验证)
实验 | 现象 | 结论 |
| 无明显现象 | 猜想 ______ 不成立 |
| ______ | 猜想三成立 |
(反思与拓展)
![]() 写出氢化钙
写出氢化钙![]() 与水反应的化学方程式______。
与水反应的化学方程式______。
![]() 若向
若向![]() 的溶液中加入一定量的
的溶液中加入一定量的![]() ,充分反应,产生的气体有氢气和______。
,充分反应,产生的气体有氢气和______。
![]() 登山运动员携带
登山运动员携带![]() 作为能源提供剂与携带氢气相比,其优点是______
作为能源提供剂与携带氢气相比,其优点是______![]() 写一条即可
写一条即可![]() 。
。
【题目】建立“宏观一微观一符号”间的联系是化学学习的重要思想。
(1)如图所示是两瓶无色气体,若一瓶是氧气,一瓶是空气(只考虑空气中的氮气和氧气),请设计实验加以区别。完成下表内容,
实验操作 | 实验现象 | 实验结论 |
______________________ | ______________________ | ______________________ |
(2)请在如图的集气瓶中,用![]() 和●表示不同的原子,画出其微观示意图,这样我们还可以从微观视角对两瓶气体进行本质上的区别____。
和●表示不同的原子,画出其微观示意图,这样我们还可以从微观视角对两瓶气体进行本质上的区别____。
(3)我们可以通过原子结构示意图认识原子的结构,氧原子的结构示意图为___________,氧化物中氧元素一般呈-2价的原因是__________________________。