题目内容
【题目】山东是海洋大省,有着丰富的海洋资源,开发前景十分远大。
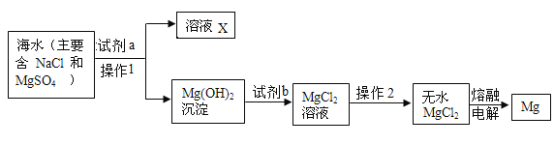
(1)海水中溶有大量的盐。目前,从海水中提取食盐,主要用“盐田法”,主要流程如下:
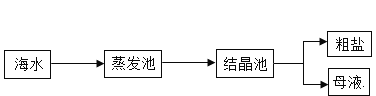
海水“晒盐”所利用的原理是_____结晶(填“蒸发”“降温”之一),海水“晒盐”后得到的母液是氯化钠的_____溶液(填“饱和”“不饱和”之一)。
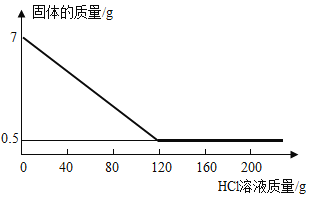
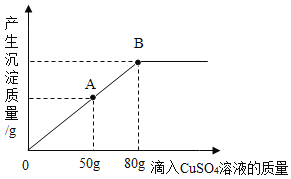
(2)氯化钠不但是生活中一种重要的调味品,还是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为: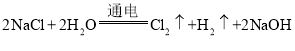 。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到50g NaOH不饱和溶液,向盛有该溶液的烧杯中逐滴滴入溶质质量分数为10%的CuSO4溶液,产生沉淀的质量与所滴入CuSO4溶液质量关系曲线如图所示。
。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到50g NaOH不饱和溶液,向盛有该溶液的烧杯中逐滴滴入溶质质量分数为10%的CuSO4溶液,产生沉淀的质量与所滴入CuSO4溶液质量关系曲线如图所示。
①写出电解氯化钠溶液时观察到的1项实验现象:_____。
②当滴入CuSO4溶液至图中A点时,烧杯中溶液里含有的溶质是_____。
③当滴入10%的CuSO4溶液80g时(即B点时) ,试通过计算,求此时所得不饱和溶液的质量_____(计算结果精确到0.1g)。
【答案】蒸发 饱和 有气泡冒出 NaOH、Na2SO4 125.1g
【解析】
(1)因为氯化钠的溶解度随温度变化不大,所以海水“晒盐”所利用的原理是蒸发结晶,海水“晒盐”后得到的母液是分离晶体得到,也就是氯化钠的饱和溶液。
(2)①根据对应的信息“电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH”,可知电解氯化钠溶液时观察到的1项实验现象:有气泡冒出。
Cl2↑+H2↑+2NaOH”,可知电解氯化钠溶液时观察到的1项实验现象:有气泡冒出。
②当滴入CuSO4溶液至图中A点时,由于再加入硫酸铜溶液还有沉淀生成,所以此时烧杯中溶液里含有的溶质是剩余的氢氧化钠和生成的硫酸钠。
③当滴入10%的CuSO4溶液80g时(即B点时),此时氢氧化钠和硫酸铜恰好完全反应。
设生成的沉淀的质量为x
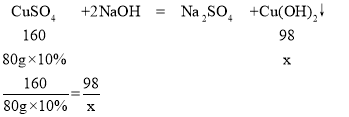
x=4.9g
此时所得不饱和溶液的质量为50g+80g-4.9g=125.1g
故答案为:
(1)蒸发;饱和;
(2)①有气泡冒出;②氢氧化钠和硫酸钠;③125.1g。

 考前必练系列答案
考前必练系列答案【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
【题目】化学学习小组进行“铝和酸溶液反应的探究”的活动。用铝片分别和氢离子浓度相同的稀盐酸、稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫酸却几乎不反应。
(提出问题)是什么原因导致两者的差异?
两种酸中氢离子浓度相同,那么存在的差异就可能跟H+所处的环境不同有关(如阴离子的不同)。
(作出猜想)猜想一:Cl-能促进金属铝与H+的反应。
猜想二:_____。
猜想三:铝表面的致密氧化膜有保护作用,使H+与铝不易接触。
为了验证上述假设,经充分讨论,大家设计了如下实验方案进行验证。
(查阅资料)已知 9.8%H2SO4 溶液和 7.3%HCl 溶液中 H+浓度相同。
(设计实验)
① | 9.8%H2SO4溶液5mL+铝片 | 不加其他试剂(对比) | 无气泡 |
② | 9.8%H2SO4溶液5mL+铝片 | 加入_____溶液 | 有较多气泡 |
③ | 9.8%H2SO4溶液5mL+铝片 | 加入 0.5mL Na2SO4 溶液 | 无气泡 |
④ | 7.3%HCl 溶液 5mL+铝片 | 加入_____溶液 | 有较多气泡 |
⑤ | 7.3%HCl 溶液 5mL+铝片 | 不加其他试剂(对比) | 有较多气泡 |
由实验②③得出猜想_____成立;由④⑤得出猜想_____不成立。为了验证猜想一成立,小明认为只需要在 5mL 9.8%H2SO4 溶液和铝片中加入_____,并与实验①对比即可。
(实验拓展)对于有气体生成的化学反应,我们可以用产生气体的速率来比较反应速率。为准确比较,应该测量收集相同体积气体所需的_____,因此,上述收集氢气应该采用_____法。
为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。
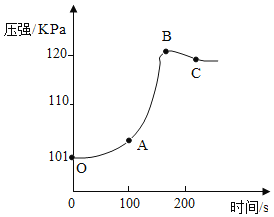
请解释曲线变化的原因:
OA 段_____;AB 段_____;BC 段_____。指出反应结束并恢复到常温时集气瓶内的压强值约为_____kpa。