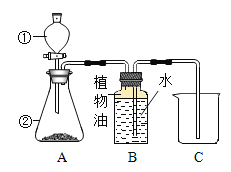
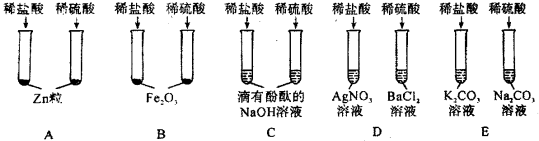
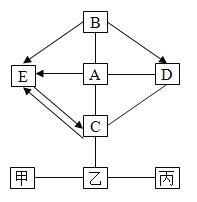
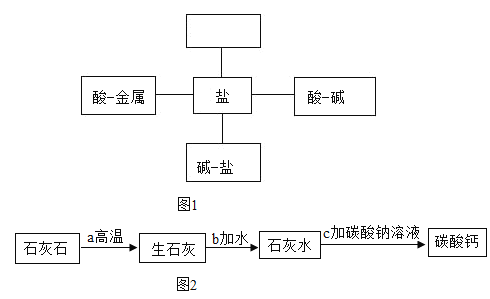
题目内容
【题目】从废铝锅上剪下6g铝片(表面被氧化,且含有不与酸反应的杂质)放在烧杯中。将100g稀盐酸分5次加入烧杯中。测得烧杯中物质的质量变化如下表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中的质量/g | 26 | 46 | 65.9 | 85.8 | 105.8 |
(1)第5次加入稀盐酸时,烧杯中溶质是
(2)求铝片中铝单质的质量分数。
(3)在下图中画出生成H2的质量与所加稀盐酸的质量关系。
(4)已被氧化的铝占未被氧化前铝片的质量分数是 。
【答案】(1)AlCl3、HCl;(2)30%;(3)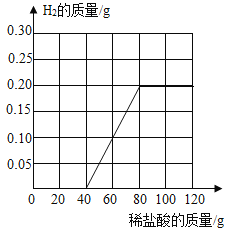 ;(4)40.9%;
;(4)40.9%;
【解析】
氧化铝和稀盐酸反应生成氯化铝和水,铝和稀盐酸反应生成氯化铝和氢气,
(1)由表可知,前两次分别加入稀盐酸后,质量没有变化,没有气体生成,说明先进行的是氧化铝和稀盐酸反应生成氯化铝和水的反应,从第3次开始反应前后质量开始变化,铝和稀盐酸反应生成氯化铝和氢气,第3次加入稀盐酸生成氢气的质量=20g×3+6g-65.9g=0.1g,第4次加入稀盐酸后生成氢气的总质量=20g×4+6g-85.8g=0.2g,可知铝和每20g稀盐酸完全反应会生成0.1g的氢气,第5次加入稀盐酸时,生成氢气的总质量=20g×5+6g-105.8g=0.2g,说明,在第4次加入稀盐酸后,铝完全反应。第5次稀盐酸过量,因此烧杯中的溶质是反应生成的氯化铝和过量的氯化氢。
(2)解:设样品中含有Al的质量为![]() ,
,
由表中数据可知,反应生成氢气的质量是:20g×4+6g-85.8g=0.2g,
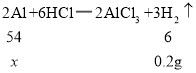
![]()
解得![]() =1.8g,
=1.8g,
所以样品中Al的质量分数为:![]() =30.0%,
=30.0%,
答:样品中Al的质量分数是30.0%。
(3)由表中数据可知,前两次分别加入稀盐酸后,质量没有变化,没有气体生成,说明先进行的是氧化铝和稀盐酸反应生成氯化铝和水的反应,当第3次加入稀盐酸时,稀盐酸才和铝反应生成氢气,加入80g稀盐酸时铝已经完全反应生成了0.2g氢气,生成H2的质量与所加稀盐酸的质量关系如下图所示:
(4)第3次实验中,20g稀盐酸中的氯化氢完全反应,设20g稀盐酸中氯化氢质量为![]() ,
,

![]()
解得![]() =3.65g,
=3.65g,
稀盐酸的质量分数为:![]() =18.25%,
=18.25%,
设氧化铝质量为![]() ,
,
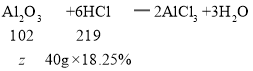
![]() ,
,
![]() =3.4g,
=3.4g,
3.4g氧化铝中铝元素质量为:3.4g×![]() ×100%=1.8g,
×100%=1.8g,
铝片中杂质质量为:6g-1.8g-3.4g=0.8g,
已被氧化的铝占未被氧化前铝片的质量分数是:![]() 40.9%。
40.9%。
答:已被氧化的铝占未被氧化前铝片的质量分数是:40.9%。

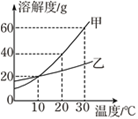
【题目】已知氯化钠、碳酸钠在不同温度时的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 7.0 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)依据上表,绘制了氯化钠和碳酸钠的溶解度曲线(如图),图中能表示碳酸钠溶解曲线的是__________(填“A”或”B”)。
(2)图中温度t2的取值范围是__________(填序号)。
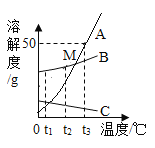
a.0~10 b.10~20 c.20~30 d.30~40
(3)保持温度为20℃,将氯化钠的不饱和溶液变成饱和溶液,写出一种可行的方法__________。
(4)在20℃,将100g水加入到30g碳酸钠固体中,充分搅拌后得到的是__________(填”饱和溶液”或”不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质量分数为__________(计算结果精确到0.1%)。