题目内容
【题目】(4分)某班同学为验证酸的化学通性,做了五组实验。分析并回答问题。
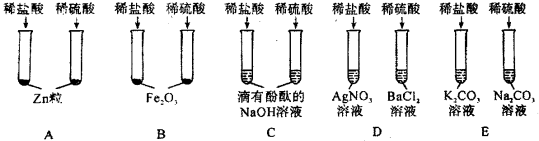
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是: 。
(2)写出B组任一试管中发生反应的化学方程式: 。
(3)C组试管中实验现象相同,该现象是 。
(4)上述五组实验中没有体现酸的通性的是 (填序号)。
【答案】(1)盐酸易挥发,使得H2中含有HCl气体而不纯
(2)Fe2O3 + 6HCl === 2FeCl3 + 3H2O
(3)红色溶液逐渐变为无色
(4)D
【解析】
试题分析:A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是盐酸易挥发,使得H2中含有HCl气体而不纯;B组任一试管中发生反应的化学方程式Fe2O3 + 6HCl === 2FeCl3 + 3H2O 或Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O;C组试管中实验现象相同,该现象是红色溶液逐渐变为无色,因为氢氧化钠会和酸反应;实验中没有体现酸的通性的是D,过程中是其中的酸根离子和金属离子生成了沉淀,没有与酸中的氢离子有关。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目