题目内容
(5分)普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。为测定黄铜中铜的质量分数,取样品10 g,分四次向其中加入稀硫酸使之充分反应,实验数据记录如下表:
认真分析数据,回答下列问题:
(1)该过程中发生反应的化学方程式为 。
(2)黄铜中铜的质量分数为 。
(3)加入的稀硫酸溶液中硫酸的质量分数是 。(写出计算过程)
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀硫酸的质量/g | 10 | 10 | 10 | 10 |
| 剩余固体的质量/g | 8.7 | 7.4 | 7 | 7 |
(1)该过程中发生反应的化学方程式为 。
(2)黄铜中铜的质量分数为 。
(3)加入的稀硫酸溶液中硫酸的质量分数是 。(写出计算过程)
(1)Zn+H2SO4=ZnSO4+H2↑ (2)70% (3)19.6%
试题分析:由题意可得:锌与硫酸反应,而铜不反应,且铜的质量为7g。故有:
(1)该过程中发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑;
(2)黄铜中铜的质量分数为
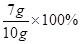 =70%;
=70%;(3)设加入的稀硫酸溶液中硫酸的质量是X。
Zn + H2SO4 = ZnSO4 + H2↑
65 98
(10-8.7)g X
65:98=1.3g:X
X=1.96g
加入的稀硫酸溶液中硫酸的质量分数是
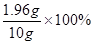 =19.6%。
=19.6%。答:(1)该过程中发生反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑。
(2)黄铜中铜的质量分数为70%。
(3)加入的稀硫酸溶液中硫酸的质量分数是19.6%。
点评:书写化学方程式要遵循客观事实和质量守恒定律两个原则,注意化学式要正确,不要忘记反应条件、气体或者沉淀符号。
金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈;位置在前的金属能把位于其后的金属从其盐溶液中置换出来。
溶质质量分数=
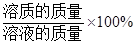 。
。
练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
