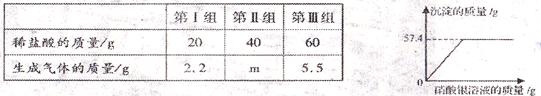
题目内容
为测定实验室中一瓶标签破损的稀硫酸中溶质的质量分数,取该稀硫酸20g与足量锌粒完全反应,收集到0.08g氢气。
(1)化学反应前后元素的种类和质量不变,据此可知,20g稀硫酸里溶质硫酸中含有氢元素的质量是 g。
(2)用两种方法计算稀硫酸中溶质的质量分数。
(1)化学反应前后元素的种类和质量不变,据此可知,20g稀硫酸里溶质硫酸中含有氢元素的质量是 g。
(2)用两种方法计算稀硫酸中溶质的质量分数。
(1)0.08g
(2)19.6% 化学方程式 和 化学式两种方法计算
(2)19.6% 化学方程式 和 化学式两种方法计算
试题分析:(1)根据质量守恒定律可知,在化学变化过程中,元素的种类和质量都不变;根据题意,稀硫酸与足量的锌完全反应,故生成的氢气的质量0.08g就是20g稀硫酸里溶质硫酸中含有的氢元素的质量。
(2)方法一:利用硫酸中氢元素的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式,即可计算出稀硫酸中溶质的质量分数。
解:稀硫酸中溶质质量=0.08g÷
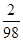 =3.92g,
=3.92g,则稀硫酸中溶质质量分数=
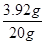 ×100%=19.6%
×100%=19.6%方法二:根据锌与硫酸反应的化学方程式,由生成的氢气的质量可以计算出稀硫酸中溶质硫酸的质量,再利用溶质质量分数的计算公式,即可计算出稀硫酸中溶质的质量分数。
解:设20g稀硫酸中溶质硫酸的质量为x
Zn+H2SO4=ZnSO4+H2↑
98 2
x 0.08g
98:x =2:0.08g
解得,x=3.92g
则稀硫酸中溶质质量分数=
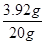 ×100%=19.6%
×100%=19.6%答:稀硫酸中溶质的质量分数为19.6%。
点评:本题难度不大,理解和熟练掌握质量守恒定律中的元素质量守恒,以及有关化学式、化学方程式的计算是解题的关键;另外,注意要有完整的计算步骤和规范的书写格式。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目