题目内容
利用废铁屑与一定质量分数的稀硫酸反应制取硫酸亚铁。现有80g废铁屑与430mL20%的稀硫酸(密度为1.4g/cm3)恰好完全反应(假设废铁屑中除铁以外的物质不溶于水且不与稀硫酸反应)。我能完成下列计算(结果保留整数):
⑴稀硫酸中溶质的质量;
⑵废铁屑中铁的质量;
⑶恰好完全反应时所得溶液中溶质的质量分数。
⑴稀硫酸中溶质的质量;
⑵废铁屑中铁的质量;
⑶恰好完全反应时所得溶液中溶质的质量分数。
(1)稀硫酸中溶质的质量约为120g;
(2)废铁屑中铁的质量约为69g;
(3)恰好完全反应时所得溶液中溶质的质量分数约为30%。
(2)废铁屑中铁的质量约为69g;
(3)恰好完全反应时所得溶液中溶质的质量分数约为30%。
试题分析:解:稀硫酸中溶质的质量为1.4g/cm3×430mL×20%=120.4g≈120g
设废铁屑中铁的质量为
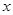 ,生成硫酸亚铁的质量为y,生成氢气的质量为z。
,生成硫酸亚铁的质量为y,生成氢气的质量为z。Fe+H2SO4=FeSO4+H2↑
56 98 152 2
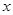 120.4g y z
120.4g y z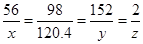
x=68.8g≈69g y≈186.7g z≈2.5g
所得溶液中溶质的质量分数为
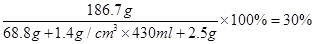
答:(1)稀硫酸中溶质的质量约为120g;
(2)废铁屑中铁的质量约为69g;
(3)恰好完全反应时所得溶液中溶质的质量分数约为30%。
点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,注意仔细分析题意,计算时避免马虎大意。

练习册系列答案
相关题目