题目内容
【题目】碘化钾(KI)保存不当会变质。实验小组进行以下实验探究KI变质的因素。
(提出问题1) KI变质的条件是什么?
(查阅资料)
① KI为白色粉末,暴露在空气中或久置会被氧化为碘(I2)而泛黄变质。
② 碘水中含较多KI时,滴加淀粉溶液显紫色或蓝紫色
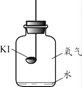
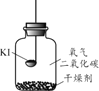
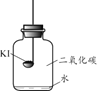
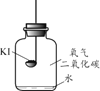
(进行实验)分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮、表面变微黄 | 固体无明显现象 | 固体变潮、无其他明显现象 | 固体变潮、表面变黄 |
继续实验:取实验1中少量微黄固体溶解,加入淀粉溶液,溶液变紫色。
取实验4中少量黄色固体溶解,加入淀粉溶液,溶液变紫色。
(解释与结论)
(1)实验3的目的是_______。
(2)对比实验_______,可以得出KI变质一定与水有关。
(3)从上述实验可推知,KI变质的条件是_______。
(4)CO2的作用是______。
【答案】证明有H2O和CO2无O2的条件下,碘化钾是否变质 2和4 H2O和O2同时存在 提供酸性环境,加快碘化钾变质
【解析】
(1)实验3的目的是:证明有H2O和CO2无O2的条件下,碘化钾是否变质;
(2)对比实验2和4,可以得出KI变质一定与水有关;
(3)从上述实验可推知,KI变质的条件是:H2O和O2同时存在;
(4)CO2在KI变质过程中的作用是:提供酸性环境,加快碘化钾变质。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
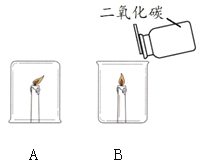
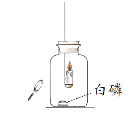
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。
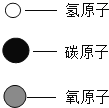
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
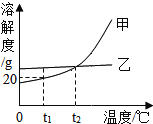
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
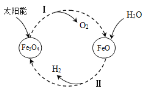
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。