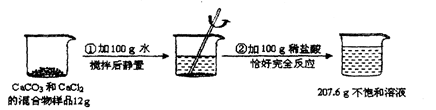��Ŀ����
ij������Һ�к����Ȼ��ơ��Ȼ�ͭ���Ȼ�������ij����С��Ҫ�ӷ�Һ�л���ͭ���õ����죨��Ҫ�ɷ�Fe2O3����Ҫ��ȫ���̲�������������Ԫ�ء����ʵ�鷽������ͼ��ʾ��
�ش��������⣺
��1���������A�ܽ���ٽ��в���aʱ�������������� ��
��2��������Һ�м������A��Ӧ�Ļ�ѧ����ʽΪ ��
��3�������ҵ���Ҫ�ɷ��� ��
��4����������������Ҫԭ�ϣ���CO�����������Ļ�ѧ����ʽΪ ��
��5��ij�о���ѧϰС���ͬѧΪ�˲ⶨij������������Ʒ������������������ʵ������
��ȡ������Ʒ5.8g�����ձ��У�Ȼ���ټ���������ϡ���ᣬʹ֮��ַ�Ӧ����
����0.2g���������ʲ��μӷ�Ӧ�������������Ʒ��������������Ϊ �����г�������̣�����һλС������
1������
��2��Fe+CuCl2 = FeCl2+Cu
��3��ͭ
��4��3CO+ Fe2O3 2Fe+3CO2
2Fe+3CO2
��5��96.6%
�������������
��������a�õ��˹����Һ�壬������a�ǹ��˲���������ʱҪ�ò�����������
��Һ�к����Ȼ��ơ��Ȼ�ͭ���Ȼ�������Ҫ���Ȼ�ͭ��ȥ�ֲ�������������Ԫ�ؿɼ������������û���Ӧ��ͭ�û���������˳�ȥ����Fe+CuCl2 = FeCl2+Cu
��3����������Ҫԭ����һ����̼������������Ӧ�������Ͷ�����̼��
3CO+ Fe2O3 2Fe+3CO2
2Fe+3CO2
��4�����������Ͻ𣬳��������̼�����ʣ�������Ʒ�м���������ϡ�������������ᷴӦ����������������������Ӧ�Ļ�ѧ����ʽΪ��Fe+H2SO4=FeSO4+H2�������û�ѧ����ʽ�����������������ȣ�����������������������Ʒ������������
��μӷ�Ӧ����������Ϊx
Fe+H2SO4=FeSO4+H2��
56 2
x 0.2g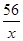 =
=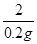
��ã�x=5.6g
������������������=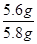 ��100%=96.6%
��100%=96.6%
���㣺���ˡ������ʡ����ݻ�ѧ��Ӧ����ʽ�ļ���

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д����Ȼ��ƺ�̼����泥�NH4HCO3�����Ʊ�̼�����ƺ��Ȼ�泥�NH4Cl�����÷�Ӧ�ɱ�ʾΪ��NaCl+NH4HCO3�TNaHCO3+NH4Cl��
20��ʱ����������ѧ����ʽ�з�Ӧ��������ȣ���100gˮ�м���11.7g NaCl
��15.8g NH4HCO3������㣺
��1�������ϴ���Һ���������������Ϊ����g��
��2����Ӧ��������Һ������NH4Cl�����������Ƕ��٣���д������ʽ���ɣ���
���ϣ�20��ʱ�������ʵ��ܽ�����£���������ͬʱ�ܽ���ˮ�и��Ե��ܽ�Ȳ��䣮
| ���� | NaCl | NH4HCO3 | NH4Cl | NaHCO3 |
| �ܽ��/g | 36.0 | 21.6 | 37.2 | 9.6 |

 2CuSO4+2H2O������һ�������ʵ���������Ϊ9.8%��ϡ����ǡ�ô���2000g��ͭ3.2%�ķ��ϣ������������ʲ������ᷴӦ�Ҳ�����ˮ������Ӧ����������ͭ��Һ�����ʵ�����������
2CuSO4+2H2O������һ�������ʵ���������Ϊ9.8%��ϡ����ǡ�ô���2000g��ͭ3.2%�ķ��ϣ������������ʲ������ᷴӦ�Ҳ�����ˮ������Ӧ����������ͭ��Һ�����ʵ�����������