��Ŀ����
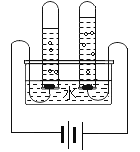
����Ŀ�������ǵ���Ҫ�ɷ���̼��ƣ�Ϊ�˲ⶨ������̼��Ƶ�����������С����С��ͬѧ����������ʵ�飬���ʵ��������ͼ��ʾ��

��1��С�����ݡ����Dz�������Ϊ4.3�ˡ�����õ�����̼��Ƶ���������Ϊ______��
��2��С�����ݡ���Ӧ�����м��ٵ���������10��+100�˩�106.7�ˣ�3.3�ˣ�Ҳ����˵�����̼��Ƶ���������������д��С���ļ�����̺ͽ��______��
��3��С����С����������ʵ��ó��ü�������̼��Ƶ�����������С������Ǻϣ������С����ʼ���ý���������Ŀ���ԭ����______��
���𰸡�57% ��̼��Ƶ�����Ϊx����Ӧ���ɶ�����̼������Ϊ��10g+100g-106.7g=3.3g��
CaCO3+2HCl=CaCl2+H2O+CO2��
100 44
x 3.3g
100/x=44/3.3g��x=7.5g��7.5g/10g��100%=75% С���������õĵ��Dz���δ��ȫ���ʵ�ʵ��Dz�������С��4.3g
��������
��1����������Ϊ10g�����Dz�������Ϊ4.3�ˣ���̼�������Ϊ5.7g��������̼��Ƶ���������=��5.7g��10g����100%=57%��
��2����̼��Ƶ�����Ϊx����Ӧ���ɶ�����̼������=10g+100g-106.7g=3.3g��
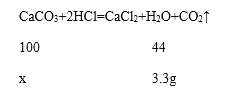
![]() =
=![]()
���x=7.5g������̼��Ƶ���������=![]() ��100%=75%
��100%=75%
�𣺵�����̼��Ƶ���������Ϊ75%��
��3��С����ʼ���ý���������Ŀ���ԭ�������õĵ��Dz���δ��ȫ���ʵ�ʵ��Dz�������С��4.3g��

 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�����Ŀ��ͬѧ�Ǵ�ɽ�ϲɼ���һ��ʯ��ʯ������ȡ80�˸���Ʒ��������ʵ�飨�������������չ����в������仯������÷�Ӧ������������m���뷴Ӧʱ�䣨t���Ĺ�ϵ���±���
��Ӧʱ��t�Ms | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
��Ӧ����������m�Mg | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
��ش��������⣺
��1����ʯ��ʯ��ȫ��Ӧ������CO2������Ϊ g��
��2�����ʯ��ʯ��CaCO3������������д��������̣�