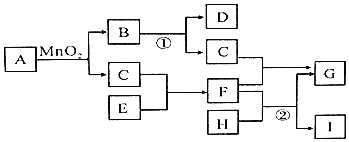
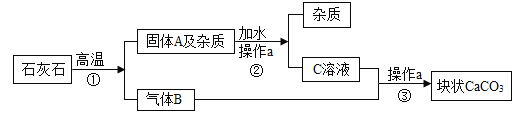
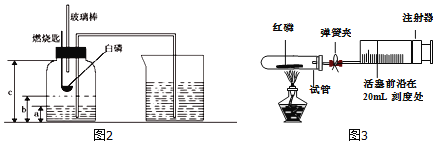
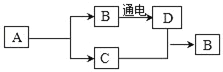
题目内容
【题目】化学兴趣小组的同学探究金属和盐溶液反应时,发现将钠放入![]() 溶液中有气泡和白色沉淀产生。为了进一步探究,小组同学将充分反应后的混合物过滤,得固体A和滤液B。
溶液中有气泡和白色沉淀产生。为了进一步探究,小组同学将充分反应后的混合物过滤,得固体A和滤液B。
![]() 查阅资料)钠与水反应生成氢氧化钠和氢气
查阅资料)钠与水反应生成氢氧化钠和氢气
(分析、思考、实验)钠放入![]() 溶液中产生的气泡,应该是______;取固体A加入过量稀盐酸,A全部溶解,且无气泡产生,此反应的化学方程式为______;
溶液中产生的气泡,应该是______;取固体A加入过量稀盐酸,A全部溶解,且无气泡产生,此反应的化学方程式为______;
提出问题)滤液B中的溶质成分是什么?
(提出猜想)猜想![]() :有
:有![]() 和NaOH猜想
和NaOH猜想![]() :有
:有![]() 和
和![]()
猜想![]() :______;
:______;
(实验设计)
实验操作 | 实验现象或发生反应的方程式 | 实验结论 |
方案一:取滤液B少许于试管中,滴入硫酸铜溶液 | 无明显现象 | 猜想 |
方案二:取滤液B少许于试管中,滴入氢氧化钠溶液 | 方程式为:______ | 猜想 |
方案三:取滤液B少许于试管中,滴入氢氧化钡溶液 | 现象为:______ | @@@/ |
(讨论交流)通过讨论大家一致认为方案三不可取,原因是______。
【答案】钠和水反应生成了氢气 ![]()
![]() 不正确
不正确 ![]() 产生白色沉淀 滤液中一定含有硫酸钠,无论滤液组成如何,只要加入氢氧化钡一定产生白色沉淀
产生白色沉淀 滤液中一定含有硫酸钠,无论滤液组成如何,只要加入氢氧化钡一定产生白色沉淀
【解析】
[分析、思考、实验]
钠的金属活动性较强,钠与水反应生成氢氧化钠和氢气,钠放入![]() 溶液中产生的气泡,是钠和水反应生成了氢气,故填氢气;
溶液中产生的气泡,是钠和水反应生成了氢气,故填氢气;
取固体A加入过量稀盐酸,A全部溶解,且无气泡产生,是因为盐酸和氢氧化镁反应生成氯化镁和水,反应的化学方程式故填Mg(OH)2+2HCl=MgCl2+2H2O;
[提出猜想]
根据猜想①:氢氧化钠过量时有Na2SO4和NaOH ,猜想②:硫酸镁过量时有Na2SO4和MgSO4 ,可提出猜想③:恰好完全反应时只有Na2SO4,故填Na2SO4;
[实验设计]
取滤液B少许于试管中,滴入硫酸铜溶液,无明显现象,说明滤液中不含有氢氧化钠,猜想①不成立,故填不正确;
猜想②若正确,滴入氢氧化钠溶液,会产生白色沉淀,因为硫酸镁和氢氧化钠反应生成白色沉淀氢氧化镁和硫酸钠,反应的化学方程式故填MgSO4+2 NaOH=Na2SO4+ Mg(OH)2↓;
溶液中含有硫酸根离子,取滤液B少许于试管中,滴入氢氧化钡溶液,产生白色沉淀,是因为过程中氢氧化钡和硫酸钠反应生成了硫酸钡沉淀,实验现象故填产生白色沉淀;
[讨论交流]
通过讨论大家一致认为方案三不可取,原因是滤液中一定含有硫酸钠,无论滤液组成如何,只要加入氢氧化钡一定产生白色沉淀,故填滤液中一定含有硫酸钠,无论滤液组成如何,只要加入氢氧化钡一定产生白色沉淀。

【题目】物质的性质决定用途,用途反映性质。请将下列物质与对应的性质和用途用直线连接。
(1)氧气 | (6)固态易升华吸热 | (11)用于金属切割 |
(2)二氧化碳 | (7)硬度大 | (12)制作玻璃刀 |
(3)金刚石 | (8)具有还原性 | (13)作消毒剂 |
(4)乙醇 | (9)具有助燃性 | (14)制造云雾 |
(5)一氧化碳 | (10)能杀菌消毒 | (15)冶炼金属 |
(1)________ ________ (2)_______ _______ (3)_______ _________
(4)________ ________ (5)_______ ________
【题目】钙片的标签如图所示,且钙片中只有碳酸钙中含有钙元素。为测定其真实的含钙量,小东取10片钙片放入盛足量盐酸的烧杯中,充分反应后再称取烧杯和剩余物的总质量。
小东做了三次实验,数据如下表:
物质的质量/ g | 第一次 | 第二次 | 第三次 | 平均值 |
反应前:烧杯+盐酸 | 22 | 22 | 22 | 22 |
10片钙片 | 8 | 8 | 8 | 8 |
反应后:烧杯+剩余物 | 26.7 | 26.5 | 26.9 | 26.7 |
(1)请列式计算每片此钙片含碳酸钙的质量_______。
(2)请通过计算说明此标签中的含钙量是否合理_______。