题目内容
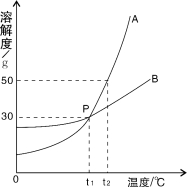
【题目】图中A、B、C分别表示三种不同的固体物质,其溶解度曲线如图所示。请回答下列问题:

(1)这三种物质的溶液中,适用于海水晒盐原理进行结晶提纯的是______。
(2)在t2℃时,将质量均为25g的上述三种物质分别加入到100g水中,不能形成饱和溶液的是______,此时A溶液的溶质质量分数为______。
(3)在t2℃时,将足量的三种物质的饱和溶液各蒸发10g水后再冷却到t2℃,它们析出晶体的质量分别为m(A)、m(B)和m(C),则三者的大小关系是______。
(4)将t2℃的这三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数分别是w(A)、w(B)和w(C),则三者的大小关系是______。
【答案】B A、B 20% m(C)<m(B)<m(A) w(B)>w(A)>w(C)
【解析】
(1)氯化钠的溶解度受温度变化影响较小,所以这三种物质的溶液中,适用于海水晒盐原理进行结晶提纯的是B;
(2)在t2℃时,A、B物质的溶解度大于25g,所以将质量均为25g的上述三种物质分别加入到100g水中,不能形成饱和溶液的是A、B,此时A溶液的溶质质量分数为![]() ×100%=20%;
×100%=20%;
(3)在t2℃时,A物质的溶解度最大,C物质的溶解度最小,所以将足量的三种物质的饱和溶液各蒸发10g水后再冷却到t2℃,它们析出晶体的质量分别为m(A)、m(B)和m(C),则三者的大小关系是:m(C)<m(B)<m(A);
(4)t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,较大温度,A、B物质的溶解度减小,C物质的溶解度增大,应该按照t2℃时的溶解度计算,所以将t2℃的这三种物质的饱和溶液分别降温至t1℃,所得溶液中溶质的质量分数分别是w(A)、w(B)和w(C),则三者的大小关系是w(B)>w(A)>w(C)。

【题目】某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。

(提出问题)这瓶溶液的溶质是什么?
(获得信息)
①酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
②实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
③氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠:猜想二:碳酸钠:猜想三:碳酸氢钠。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有 ______ 产生 | 该溶液的溶质是碳酸钠或者是 ______ |
再取一支洁净试管,加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是 ______ ,发生 反应的化学方程式为 ______ |
小华认为上面的结论不完全正确,理由是______(用化学方程式表示);小组讨论后,又进行如下实验:
取第二次实验后的上层清液,滴入无色酚酞试液,溶液呈红色。
(实验结论)这瓶溶液的原溶质是氢氧化钠。
(交流反思)实验探究中,能否用氢氧化钡溶液替代氯化钡溶液?______(填“能”或“不能”):实验中取用液体药品时,应注意密封保存。
【题目】化学兴趣小组的同学探究金属和盐溶液反应时,发现将钠放入![]() 溶液中有气泡和白色沉淀产生。为了进一步探究,小组同学将充分反应后的混合物过滤,得固体A和滤液B。
溶液中有气泡和白色沉淀产生。为了进一步探究,小组同学将充分反应后的混合物过滤,得固体A和滤液B。
![]() 查阅资料)钠与水反应生成氢氧化钠和氢气
查阅资料)钠与水反应生成氢氧化钠和氢气
(分析、思考、实验)钠放入![]() 溶液中产生的气泡,应该是______;取固体A加入过量稀盐酸,A全部溶解,且无气泡产生,此反应的化学方程式为______;
溶液中产生的气泡,应该是______;取固体A加入过量稀盐酸,A全部溶解,且无气泡产生,此反应的化学方程式为______;
提出问题)滤液B中的溶质成分是什么?
(提出猜想)猜想![]() :有
:有![]() 和NaOH猜想
和NaOH猜想![]() :有
:有![]() 和
和![]()
猜想![]() :______;
:______;
(实验设计)
实验操作 | 实验现象或发生反应的方程式 | 实验结论 |
方案一:取滤液B少许于试管中,滴入硫酸铜溶液 | 无明显现象 | 猜想 |
方案二:取滤液B少许于试管中,滴入氢氧化钠溶液 | 方程式为:______ | 猜想 |
方案三:取滤液B少许于试管中,滴入氢氧化钡溶液 | 现象为:______ | @@@/ |
(讨论交流)通过讨论大家一致认为方案三不可取,原因是______。