题目内容
【题目】元素周期表体现元素的性质随原子序数递增而呈现周期性的变化,如图是元素周期表的一部分.
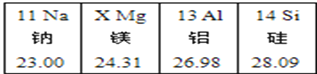
(1)表中X值是__________
(2)表中元素从左到右化合价由+1到+4价逐渐增大;金属活动性逐渐__________
(3)从表中任选一种元素,写出其氧化物的化学式__________.
(4)已知金属钠在常温下易被氧化成(Na2O),与水反应后生成氢氧化钠。请写出相应的化学方程式:___________________。
【答案】 12 减弱 Na2O Na2O+H2O=2NaOH
【解析】(1)根据图中信息可以知道,从左到右各元素的原子序数依次增大,因此x=12;
(2)四种元素中,钠的金属性最强,其次是镁,再次是铝,硅属于非金属,因此金属活动性从左到右逐渐减弱;
(3)钠显+1价,氧显-2价,根据化合物中各元素正负化合价代数和为零可知,氧化钠的化学式为Na2O;
(4)氧化钠与水反应后生成氢氧化钠,化学方程式为:Na2O+H2O=2NaOH。

【题目】今天老师拿来两瓶无标签的试剂,一瓶是固体一瓶是液体。老师将二者取少量混合在试管里,便产生了一种无色气体。我们对气体进行了多种探究。
(1)①该气体是那种物质?验证它的方案如下:
猜 想 | 试 验 步 骤 | 现 象 及 结 论 |
此气体可能是__________ | ________________ | ______________ |
产生该气体的化学方程式可能是____________________________________
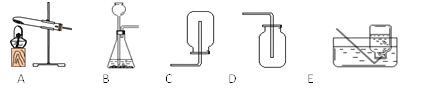
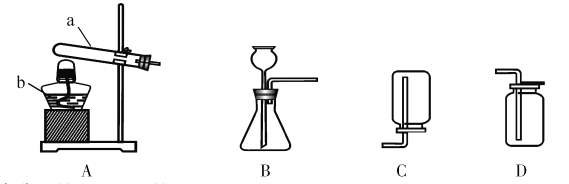
②我想制取该气体,采用的发生装置可选用下图中的_____,收集装置是____。(2)我猜想该无色气体还可能是另一种气体,制取该气体的化学方程式是_____________________________。
(3)实验室可用熟石灰和氯化铵两种固体加热反应制取氨气,氨气是一种极易溶于水、密度比空气小的气体。根据以上所述,实验室制取氨气应该选用的发生装置是_________,收集装置选用__________。