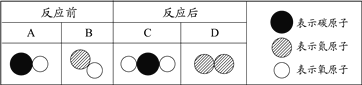
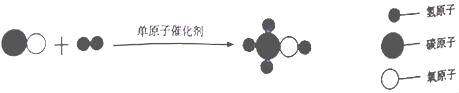
题目内容
【题目】化学研究物质的组成。
(1)用于消毒的酒精(化学式为C2H5OH)中含有_______种元素,碳、氢原子个数比为______,0.1mol酒精的质量为_______g,所含氢原子个数是____________,该物质中质量分数最高的元素为_________。
(2)如下图1、2所示的装置可以研究水的组成。
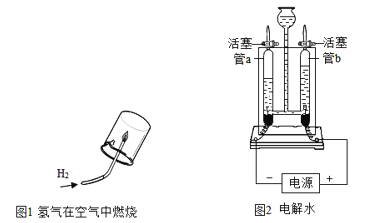
① 写出图1反应的化学方程式_______________________________。
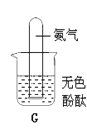
② 图2所示实验,接通直流电源一段时间后,玻璃管b内产生的气体是________,检验该气体的方法是____________,根据实验能推断出水组成的依据是_____。
③ 电解水实验需在水中加入少量硫酸以加快水的电解(硫酸不发生反应),若取36g质量分数为1%的硫酸溶液进行电解,消耗了6g水,则电解后硫酸溶液中溶质的质量分数是________。
【答案】 3 1:3 4.6 3.612×1023 C 2H2+O2![]() 2H2O O2 带火星木条放b管口处复燃 根据质量守恒定律 1.2%
2H2O O2 带火星木条放b管口处复燃 根据质量守恒定律 1.2%
【解析】(1) 消毒的酒精(化学式为C2H5OH)中含有C、H、O三种元素,碳、氢原子个数比为1:3;0.1mol酒精的质量为0.1![]() 46=4.6g,所含氢原子个数6×6.02×1023 = 3.612×1023,C、H、O三种元素的质量比为(12×2):(1×6):16=12:3:8,可知碳元素的质量最大,故质量分数最高;(2)①氢气在空气中燃烧,产生淡蓝色火焰,烧杯内壁有水雾,化学方程式为:2H2+O2
46=4.6g,所含氢原子个数6×6.02×1023 = 3.612×1023,C、H、O三种元素的质量比为(12×2):(1×6):16=12:3:8,可知碳元素的质量最大,故质量分数最高;(2)①氢气在空气中燃烧,产生淡蓝色火焰,烧杯内壁有水雾,化学方程式为:2H2+O2![]() H2O;②接通直流电源一段时间后,玻璃管b内产生的气体较少,是氧气,检验该气体的方法是带火星木条放b管口处复燃,根据质量守恒定律:化学反应前后元素的种类不变,电解水生成氢气和氧气,说明水是由氢元素和氧元素组成的;③消耗了6g水,溶液还剩36g6g=30g,而溶质没有变还是36g×1%=0.36g,则电解后硫酸钠溶液中溶质的质量分数为
H2O;②接通直流电源一段时间后,玻璃管b内产生的气体较少,是氧气,检验该气体的方法是带火星木条放b管口处复燃,根据质量守恒定律:化学反应前后元素的种类不变,电解水生成氢气和氧气,说明水是由氢元素和氧元素组成的;③消耗了6g水,溶液还剩36g6g=30g,而溶质没有变还是36g×1%=0.36g,则电解后硫酸钠溶液中溶质的质量分数为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】石灰石是常用的建筑材料。
①甲乙同学设计了如下实验方案进行探究:
Ⅰ.甲同学取石灰石按下图所示进行实验(煤气灯能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,由此甲同学认为石灰石已分解。甲同学结论不合理的理由是__________。
Ⅱ.乙同学进行如下实验,完成下表
实验步骤 | 实验现象 | 实验结论 |
取少量煅烧后固体于试管中,加水振荡,过滤,取滤液,滴加____________溶液 | 溶液变红 | 证明固体中 含有________ |
取滤渣滴加足量的稀盐酸 | _______ | 含有碳酸钙 |
②为了测定石灰石中碳酸钙的质量分数(假设杂质不参加反应),乙同学设计称取一定质量的石灰石样品,高温煅烧至质量不再改变。实验中固体的质量变化如下:
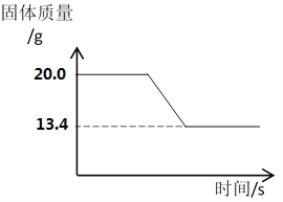
Ⅰ.生成二氧化碳的质量是____________g。[
Ⅱ.求石灰石中碳酸钙的物质的量。(根据化学方程式,写出计算过程)___________