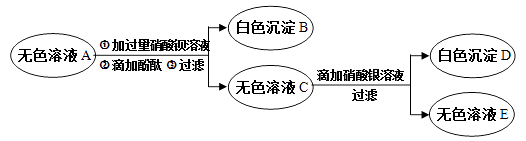
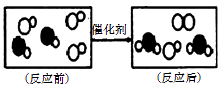
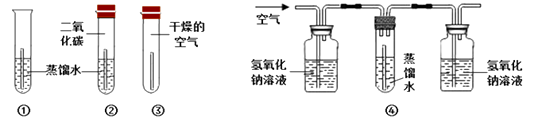
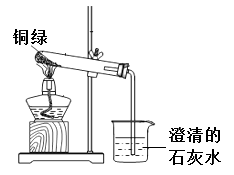
题目内容
【题目】把干燥纯净的氯酸钾和二氧化锰的混合物31g加热分解,反应完全后,剩余固体物质的质量为21.4g,求:
(1)生成氧气的质量
(2)混合物中氯酸钾的质量
(3)二氧化锰的重量
【答案】(1)9.6g (2)24.5g (3)6.5g
【解析】(1)根据质量守恒定律,反应前氯酸钾和二氧化锰的混合物31g,反应后剩余固体物质的质量为21.4g,所以生成氧气的质量为31g-21.4g=9.6g;(2)氯酸钾的质量是![]() ,
, ![]()
![]()
![]()
245 96
![]() 9.6g
9.6g
![]()
解得: ![]() =24.5g
=24.5g
(3)因为氯酸钾和二氧化锰的混合物31g,参加反应的氯酸钾为24.5g,所以二氧化锰的质量为31g-24.5g=6.5g。
答:(1)生成氧气的质量为9.6g,原混合物中氯酸钾的质量为24.5g,二氧化锰的质量为6.5g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列对事实的解释正确的是( )
选项 | 事实 | 解释 |
A | 氧气和液氧都有氧化性 | 分子是保持物质化学性质的最小粒子 |
B | 干冰升华后体积增大 | 气体分子体积大于固体分子体积 |
C | 过氧化氢溶液为混合物 | 溶液中含有不同种类的原子 |
D | 盐酸和稀硫酸具有相似的化学性质 | 盐酸和稀硫酸中都含有酸根离子 |
A.A B.B C.C D.D
【题目】下列有关“物质——性质——用途”的叙述中,用途与性质不相关的是
序号 | 物质 | 性质 | 用途 |
A | 一氧化碳 | 可燃性 | 冶炼金属 |
B | 氧气 | 支持呼吸 | 医疗急救 |
C | 活性炭 | 吸附性 | 防毒面具 |
D | 干冰 | 蒸发时吸收热量 | 制冷剂 |
A.AB.BC.CD.D