题目内容
【题目】K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体材料的主要原料。某研究性小组对K2SO4和Mn3O4的制备展开了系列研究。
Ⅰ.以硫酸工业的尾气SO2制备K2SO4的工艺流程如下:
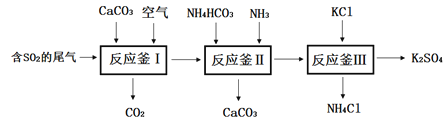
(1)反应釜I中发生的反应包括: 2CaCO3 + 2SO2+O2=2_______+2CO2
(2)反应釜III:向反应II 所得(NH4)2SO4溶液中加入KCl溶液充分反应后,经蒸发浓缩、过滤 、洗涤、干燥等操作即可制得K2SO4产品。为提高K2SO4产品纯度,过滤时应控制反应液的温度范围为______(填字母序号,如图为几种盐的溶解度曲线)。
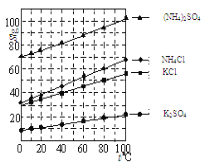
A 0℃-10℃ B 20℃-30℃ C 60℃-65℃ D 80℃-90℃
(3)上述工艺流程中循环利用的物质是_______;检验产品K2SO4中不含杂质选用的试剂是_____
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液 DNaOH溶液
Ⅱ.实验室以SO2气体为原料制备少量高纯Mn3O4的操作步骤如下:
[资料1]亚硫酸(H2SO3)在Mn2+催化作用下被O2氧化为硫酸,硫酸与MnO2在常温下不易发生反应。
[资料2] MnSO4在空气中高温煅烧生成Mn3O4和三氧化硫,当温度超过1000℃时,Mn3O4易被氧化。
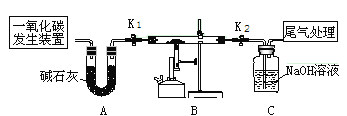
(步骤I)制备MnSO4溶液:在三颈烧瓶中(装置见(如图)加入一定量MnO2和水,先通氮气,再通入SO2和N2混合气体,搅拌反应3小时。停止通SO2,继续反应片刻后过滤得MnSO4溶液。
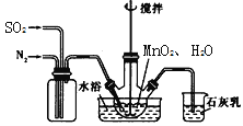
(4)烧杯中石灰乳(有效成分为氢氧化钙)的作用为____________。
(5)三颈烧瓶中生成MnSO4的反应化学方程式为______________。
(6)步骤I中,先通入氮气的目的是____________。为使SO2尽可能转化完全,在不改变固液投料和通入的SO2和N2比例一定的条件下,可采取的合理措施有:及时搅拌反应液、____________(任写1条)。
(步骤II)制备MnSO4H2O晶体:利用硫酸锰的溶解度在100℃以上随温度升高而急剧降低的原理,采用压力釜升温加压结晶法后过滤、洗涤、低温干燥得纯净的MnSO4H2O晶体。
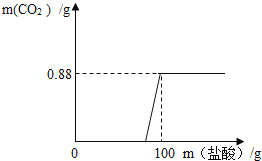
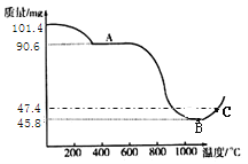
(步骤III)制备Mn3O4固体:准确称取101.4mg MnSO4H2O,将MnSO4H2O晶体在空气中高温煅烧,下图是用热重分析仪测定煅烧时温度与剩余固体质量变化曲线。
(7)Mn3O4中的Mn元素有+2,+3价,则Mn3O4中+2价和+3价锰的比例为_____
(8)该曲线中A段所表示物质的化学式为____________。
(9)试通过计算确定反应至图中C点时所对应的剩余固体成分的化学式____(请写出计算过程)。
【答案】CaSO4 D CaCO3 AC 吸收二氧化硫气体,防止空气污染 MnO2+SO2=MnSO4 排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低 控制气体流速(缓慢通入混合气体)、控制适当的温度 1:2 MnSO4 根据元素守恒求出m(Mn)=33mg;m(O)=14.4mg,求出MnxOy中的x:y=2:3 并写出Mn2O3
【解析】
(1)由化学方程式可知,反应前有2个钙原子、2个碳原子、2个硫原子和12个氧原子,反应后出现了2个碳原子和4个氧原子,隔绝质量守恒定律,尚缺2个钙原子、2个硫原子和8个氧原子,则空格处应有1个钙原子、1个硫原子和4个氧原子,所以空格处的化学式为CaSO4,故填CaSO4。
(2)提高K2SO4产品纯度,就是让硫酸钾以晶体的形式从溶液中结晶析出,而其它物质均继续溶解在溶液中,由溶解度曲线可知,在80℃-90℃时硫酸钾与其它物质的溶解度相差较大,所以过滤时应控制反应液的温度范围为80℃-90℃,故填D。
(3)从流程图中可知,碳酸钙开始是反应物,后面是生成物,所以能够循环利用的物质是CaCO3,故填CaCO3;
检验产品K2SO4中不含杂质,即硫酸钾中不含氯化铵,可通过检验氯离子来证明,方法是取少量样品加水溶解,先加入足量的 Ba(NO3)2溶液排除硫酸根离子的干扰,然后取上层清液再加入AgNO3溶液,无明显现象,故填AC。
(4)石灰乳能与二氧化硫反应,防止二氧化硫排放到空气中污染空气,故填吸收二氧化硫气体,防止空气污染。
(5)反应是二氧化锰与二氧化硫反应生成硫酸锰,故反应的化学方程式写为:MnO2+SO2=MnSO4。
(6)反应时先通入氮气能够排净容器中的空气,避免二氧化锰与氧气反应生成硫酸,降低硫酸锰的生产率,故填排尽装置内的空气,防止SO2气体被氧化为硫酸,导致转化率降低;
控制气体流速,能够延长物质的反应时间,从而提高生成物的转化率,也可以控制适当的温度,即适当提高反应的温度,但反应物均为气体,温度也不宜太高,故填控制气体流速(缓慢通入混合气体)、控制适当的温度。
(7)Mn3O4中的Mn元素有+2,+3价,氧元素的化合价为-2价,根据化合物中各元素的化合价的代数和为零,则Mn3O4中+2价和+3价锰的比例为1:2,故填1:2。
(8)由图及题文可知,A段前是MnSO4H2O晶体在空气失去结晶水的过程,固体的质量逐渐减少,所以A段所表示物质是硫酸锰,其化学式为MnSO4,故填MnSO4。
(9)解:101.4mg MnSO4H2O中锰元素的质量为101.4mg×![]() ×100%=33mg
×100%=33mg
对应C点物质中的氧元素的质量为47.4mg33mg=14.4mg
则物质中的锰原子与氧原子的个数比为![]() :
:![]() =2:3
=2:3
所以该物质的化学式为Mn2O3,故填Mn2O3。

 走进文言文系列答案
走进文言文系列答案【题目】分析处理图表中的信息是学习化学的一种重要方法。
(1)如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
Ⅰ.20℃时,NaCl的溶解度是_____g。
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为_____(只列计算式,不需要计算结果)。
Ⅲ.KNO3 中含少量氯化钠时,提纯硝酸钾的一般方法是_____。
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是_____。
(2)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
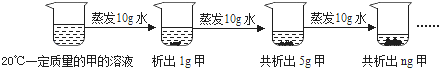
Ⅰ.蒸发前原溶液是_____(填“饱和”或“不饱和”)溶液。n的数值是_____。
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是_____(填字母)。
A 随温度升高而增大 B 随温度升高而减小 C 无法判断
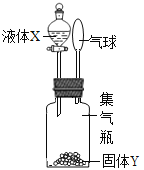
【题目】如图所示,将液体X加入到集气瓶中与固体Y作用,观察到气球逐渐变大,如表中液体X和固体Y的组合,符合题意的是( )
① | ② | ③ | ④ | ⑤ | |
X | 稀盐酸 | 水 | 水 | 双氧水 | 水 |
Y | 铁粉 | 氢氧化钠 | 氯化钠 | 二氧化锰 | 硝酸铵 |
A. ①②⑤ B. ①③④ C. ①②④ D. ②③⑤