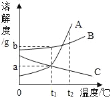
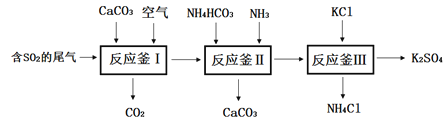
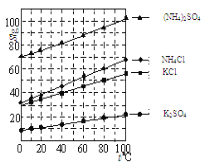
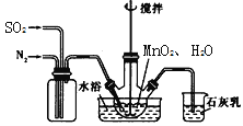
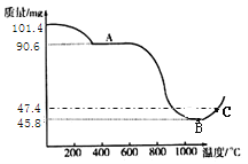
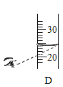
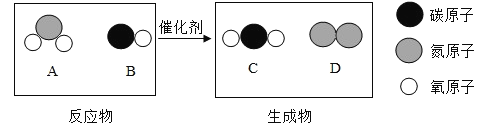
题目内容
【题目】用化学用语表示:
①三个氮原子________;②两个亚铁离子_____;③负二价的硫元素_______;④ 菱铁矿的主要成分_____。
【答案】3N 2Fe2+ ![]() FeCO3
FeCO3
【解析】
本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目。
①原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以3个氮原子,就可表示为3N;
②离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.亚铁离子带2个单元位的正电荷,表示为Fe2+,若表示多个该离子,就在其元素符号前加上相应的数字,所以答案为2Fe2+;
③元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以负二价的硫元素,故可表示为![]()
④菱铁矿的主要成分是碳酸亚铁,其化学式为:FeCO3

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目