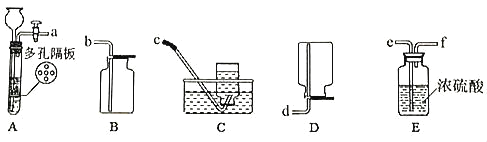
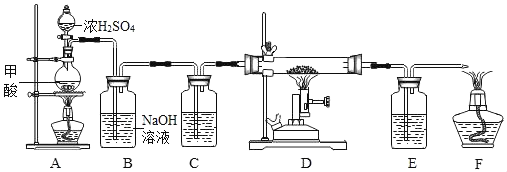
��Ŀ����
����Ŀ��þ�Ŀ��ã���þ�������ܡ�
���Ϣ٣�þ�����ڵ�����������̼��ȼ�գ�þҲ����ˮ��Ӧ��
���Ϣڣ������£������ʿ�ʼ������pH���±���
���� | �������� | �������� | ������þ |
��ʼ������pH | 1.5 | 3.3 | 9.4 |
��ʶþ
��1��þԪ�ص������Ϣ�� ��������þԭ�ӵĽṹʾ��ͼ��______��
��������þԭ�ӵĽṹʾ��ͼ��______��
��Ѱþ
�ÿ�ʯ����MgO��Fe2O3��Al2O3��SiO2���Ʊ�������þ������ʾ��ͼ���£�
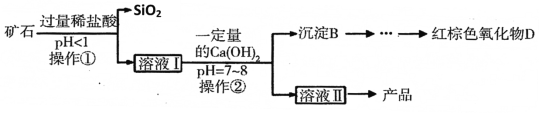
��2���Ӹ������Ʋ�SiO2���еĻ�ѧ������______��дһ������
��3����������������Fe2O3��Ӧ�Ļ�ѧ����ʽΪ______��
��4��ʵ������ɲ��������ò�������������______��
��5����Һ���е���������______�֡�
��6������B�ijɷ��� ______ ��
����þ
��7����ҵ���õ�������Ȼ�þ��ȡþ����������ȴþ���������������______��
������þ
��8��þ�Ͻ�㷺����Я��ʽ����е��������ҵ�У��ﵽ��������Ŀ�ģ���Ҫ������������______��дһ�㣩��
���𰸡�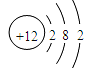 ������ϡ���ᷴӦ Fe2O3+6HCl = 2FeCl3+3H2O ����ʱ���� 4 Fe(OH)3 ��Al(OH)3 ϡ�����壨�纤���ȣ� �ܶ�С����Ӳ�ȴ���ʴ���������ɣ�
������ϡ���ᷴӦ Fe2O3+6HCl = 2FeCl3+3H2O ����ʱ���� 4 Fe(OH)3 ��Al(OH)3 ϡ�����壨�纤���ȣ� �ܶ�С����Ӳ�ȴ���ʴ���������ɣ�
��������
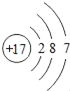
��1����Ԫ�����ڱ��У����Ͻǵ����ֱ�ʾԭ��������þԭ�ӵ�������Ϊ12�����ݺ�������Ų����ɿ�֪����1����2�����ӣ���2����8�����ӣ���3����2�����ӣ�þԭ�ӵĽṹʾ��ͼΪ��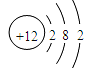 ��
��
��2����������ͼ��֪����ʯ����������˵õ�SiO2�����Ʋ�SiO2���еĻ�ѧ������SiO2������ϡ���ᷴӦ��
��3��������Fe2O3��Ӧ�����Ȼ�����ˮ����Ӧ�Ļ�ѧ����ʽΪFe2O3+6HCl = 2FeCl3+3H2O��
��4����������ͼ��֪���������ǽ������Һ����룬�������ǹ��ˣ����ò������������ǹ���ʱ������
��5��MgO��Fe2O3��Al2O3���������ᷴӦ�ֱ����ӳ��Ȼ�þ���Ȼ������Ȼ�����ˮ����Һ���е���������þ���ӡ������ӡ������Ӻ������ӣ����������������4�֣�
��6���Ȼ�þ���������Ʒ�Ӧ����������þ�������Ȼ��ƣ��Ȼ������������Ʒ�Ӧ�������������������Ȼ��ƣ��Ȼ������������Ʒ�Ӧ�������������������Ȼ��ƣ�pH������7��8ʱ���������Ϣڿ�֪��������þ���γɳ���������B�ijɷ���Fe(OH)3 ��Al(OH)3��
��7���������Ϣٿ�֪��þ�Ļ�ѧ���ʽϻ��ã����û�ѧ���ȶ���ϡ��������ȴþ��������ҵ���õ�������Ȼ�þ��ȡþ����������ȴþ���������������ϡ�����壨�纤������
��8��þ�Ͻ�㷺����Я��ʽ����е��������ҵ�У��ﵽ��������Ŀ�ģ���Ҫ�������������ܶ�С����Ӳ�ȴ���ʴ���������ɣ���

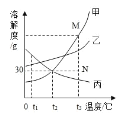
����Ŀ�������±��ش����⡣
�¶ȣ����� | 20 | 40 | 50 | 60 | 80 | |
�ܽ�� ��g/100g ˮ�� | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
��1���ϱ��е�����������20��ʱ��___________���ܽ�����
��2����40 ��ʱNH4Cl��NaCl�����ֱ�����Һ������60 �棬��������Һ����������������С��ϵ�ǣ�NaCl_____NH4Cl����д����������������������
��3������KNO3 ��Һ�л���������NaCl��Ҫ�õ�KNO3 ����ķ�����_______��
��4��A��80�溬��120 gˮ��KNO3��Һ���������²������õ�102 gKNO3���塣
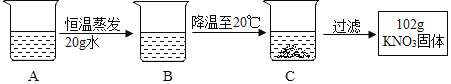
�����Ϲ��̵ķ�������ȷ����__________��ѡ���ţ���
�� A��B�Ĺ����У���������û�иı�
�� B���������ܼ���������Ϊ 169:100
�� ��ʼ����KNO3������¶���60����80��֮��
�� A��Һ����������222 g