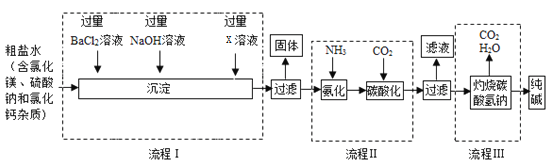
题目内容
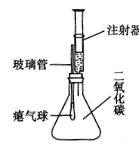
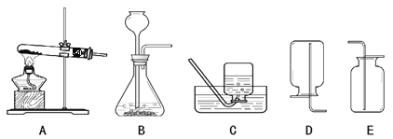
【题目】制取气体是初中化学必修内容,实验室制取气体的有关装置图如图所示。
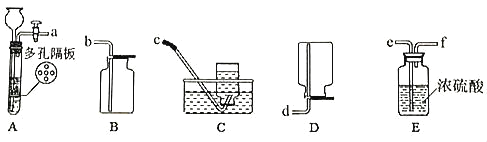
(1)写出实验室用A装置制取氧气的化学方程式_____。
(2)写出用A装置制取气体的优点是_____。
(3)若在实验室中选用上述装置制取并收集一瓶干燥的氢气,所选用仪器的导管接口从左到右的连接顺序为_____。
【答案】2H2O2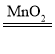 2H2O+O2↑ 能控制反应的发生和停止 aefd
2H2O+O2↑ 能控制反应的发生和停止 aefd
【解析】
(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰作催化剂的条件下生成水和氧气;故答案为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)关闭阀门,气体不能排出,试管内压强变大,液体被压进长颈漏斗中,液体与固体分离,反应停止,打开阀门,气体排出,压强变小,液体进入试管中,试管中液面升高,液体与固体接触,反应开始发生,所以A装置制取气体的优点是:能控制反应的发生和停止;故答案为:能控制反应的发生和停止;
(3)浓硫酸具有吸水性,可干燥氢气,装置E是洗气装置,洗气装置是长进短出,氢气的密度比空气的密度小,用向下排空气法收集。若在实验室中选用上述装置制取并收集一瓶干燥的氢气,所选用仪器的导管接口从左到右的连接顺序为:aefd;故答案为:aefd;

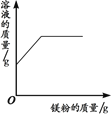
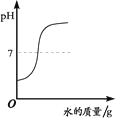
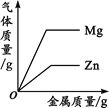
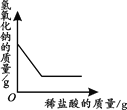
【题目】下列四个图像中,能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的稀盐酸中加入过量的镁粉 | B.向一定量的稀盐 | C.向两份完全相同的稀盐酸中分别加入锌粉、镁粉 | D.向一定量氢氧化钠溶液中滴加稀盐酸 |
A. AB. BC. CD. D
【题目】镁的课堂,“镁”的享受。
资料①:镁可以在氮气、二氧化碳中燃烧;镁也能与水反应。
资料②:常温下,各物质开始沉淀的pH如下表:
物质 | 氢氧化铁 | 氢氧化铝 | 氢氧化镁 |
开始沉淀的pH | 1.5 | 3.3 | 9.4 |
Ⅰ.识镁
(1)镁元素的相关信息“ ”,画出镁原子的结构示意图:______。
”,画出镁原子的结构示意图:______。
Ⅱ.寻镁
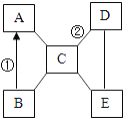
用矿石(含MgO、Fe2O3、Al2O3和SiO2)制备氢氧化镁的流程示意图如下:
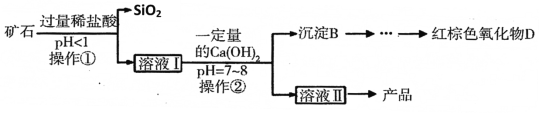
(2)从该流程推测SiO2具有的化学性质是______(写一条)。
(3)操作①中盐酸与Fe2O3反应的化学方程式为______。
(4)实验室完成操作②所用玻璃棒的作用是______。
(5)溶液Ⅰ中的阳离子有______种。
(6)沉淀B的成分有 ______ 。
Ⅲ.炼镁
(7)工业上用电解融熔氯化镁制取镁,可用来冷却镁蒸气的气体可以是______。
Ⅳ.用镁
(8)镁合金广泛用于携带式的器械和汽车行业中,达到轻量化的目的,主要利用其性质是______(写一点)。