题目内容
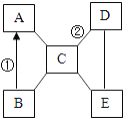
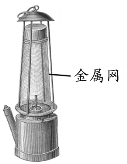
【题目】1815年,英国化学家戴维发明了煤矿安全灯——戴维灯(如右图):采用一种网眼很小的金属网罩住煤油火焰,火焰仅在网中燃烧而不引燃矿坑内的瓦斯(主要成分是甲烷)。下列分析正确的是( )
A. 金属网罩可降低甲烷的着火点
B. 灯内煤油燃烧耗尽氧气,则甲烷无法燃烧
C. 金属网吸收热量,使温度低于甲烷着火点
D. 戴维灯的使用可极大缩小甲烷的爆炸极限
【答案】C
【解析】
戴维灯采用一种网眼很小的普通金属网罩住火焰,由于金属能够吸收热量并散放到空气中,使金属周围的温度降低,甲烷的温度达不到着火点,所以不会引燃外界的甲烷气体。
A、金属网罩吸收热量,可降低温度,使温度达不到甲烷的着火点,故A错误;
B、金属网罩吸收热量,可降低温度,使温度达不到甲烷的着火点,不是灯内煤油燃烧耗尽氧气,故B错误;
C、金属网罩吸收热量,可降低温度,使温度低于甲烷的着火点,故C正确;
D、爆炸极限体现了物质的一种性质,戴维灯的使用不能极大缩小甲烷的爆炸极限,故D错误。故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】镁的课堂,“镁”的享受。
资料①:镁可以在氮气、二氧化碳中燃烧;镁也能与水反应。
资料②:常温下,各物质开始沉淀的pH如下表:
物质 | 氢氧化铁 | 氢氧化铝 | 氢氧化镁 |
开始沉淀的pH | 1.5 | 3.3 | 9.4 |
Ⅰ.识镁
(1)镁元素的相关信息“ ”,画出镁原子的结构示意图:______。
”,画出镁原子的结构示意图:______。
Ⅱ.寻镁
用矿石(含MgO、Fe2O3、Al2O3和SiO2)制备氢氧化镁的流程示意图如下:
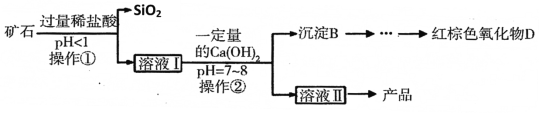
(2)从该流程推测SiO2具有的化学性质是______(写一条)。
(3)操作①中盐酸与Fe2O3反应的化学方程式为______。
(4)实验室完成操作②所用玻璃棒的作用是______。
(5)溶液Ⅰ中的阳离子有______种。
(6)沉淀B的成分有 ______ 。
Ⅲ.炼镁
(7)工业上用电解融熔氯化镁制取镁,可用来冷却镁蒸气的气体可以是______。
Ⅳ.用镁
(8)镁合金广泛用于携带式的器械和汽车行业中,达到轻量化的目的,主要利用其性质是______(写一点)。
【题目】氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成。用它制备氢氧化镁的流程示意图如下图所示:
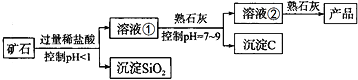
资料信息:部分金属阳离子以氢氧化物形成沉淀时溶液的pH如下表所示:
沉淀物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀 | 1.9 | 4.2 | 9.1 |
完全沉淀 | 3.2 | 6.7 | 11.1 |
根据以上信息进行分析,下列说法中错误的是
A. 加入稀盐酸时一定发生了复分解反应B. 沉淀C一定属于混合物
C. 上图所示制备氢氧化镁的流程中三次用到了过滤操作D. 溶液②中的溶质最多为2种
【题目】萱萱同学在实验室发现了一瓶久置的标签残缺的无色溶液(如图甲所示),为确认中的溶质,他设计并进行了如下探究活动,请回答下列问题。
(猜想与假设)同学们在跟实验员老师了解了情况以后,猜想其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
(查阅资料)上述四种物质的相关信息如下:
物 质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
(探究实验)
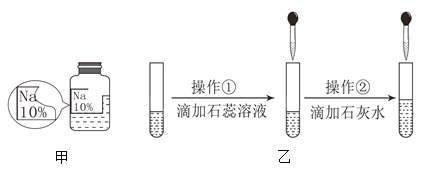
(1)通过查阅资料,他认为可以排除________________,依据是______________________。
(2)他又做了如图乙所示实验继续探究,在进行操作①后可确定溶质不是NaCl,则其实验现象是________________________。
(3)在进行操作②时有白色沉淀产生,由此又可以排除猜想中的_______________,产生沉淀的反应的化学方程式是_______________________。(探究结论)该同学经过分析后认为标签也可能是“NaOH”,他的理由是_____________。另有同学猜想其中的溶质还可能是NaNO3,但萱萱同学通过对实验现象的分析否定了这种猜想,她的理由是___________________________________________________。