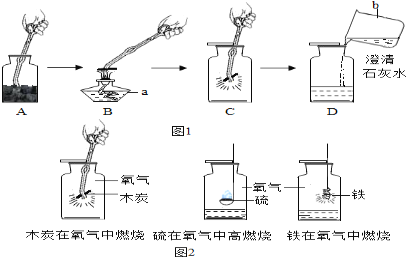
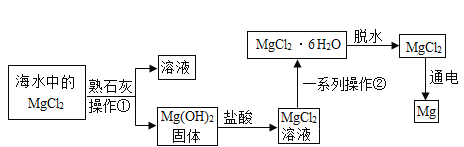
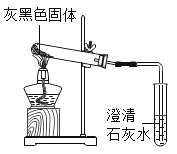
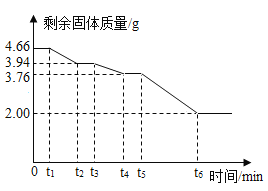
题目内容
【题目】下列说法正确的是
A. 镁条的质量等于它燃烧后生成物的质量
B. 蜡烛燃烧时逐渐变短,不符合质量守恒定律
C. 高锰酸钾受热分解的总质量等于生成物的总质量
D. 12 g碳和16 g氧气反应,可生成28 g二氧化碳
【答案】C
【解析】
试题A.镁条的质量与消耗的氧气的质量和等于它燃烧后生成物的质量。错误。B.蜡烛燃烧时逐渐变短,是因为其中的C变为CO2气体,其中的H元素变为H2O蒸汽逸出,逸出是符合质量守恒定律。错误。C.高锰酸钾受热分解得到锰酸钾、二氧化锰、氧气。化学反应的过程就是原子重新组合的过程。因此反应物的总质量等于生成物的总质量。蒸汽。D.C+O2![]() CO2。12 g.由方程式可知12g碳和32 g氧气恰好反应,而给出的氧气的质量是16g,不足量,因此产生的二氧化碳的质量按照氧气来计算。可生成22g.错误。
CO2。12 g.由方程式可知12g碳和32 g氧气恰好反应,而给出的氧气的质量是16g,不足量,因此产生的二氧化碳的质量按照氧气来计算。可生成22g.错误。

【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,引起了化学探究小组的兴趣。
(提出问题)
氧化铜能否作过氧化氢溶液分解的催化剂?
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL 5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铜粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条 复燃,B试管中无明显现象。 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木 条均复燃。 |
Ⅲ.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
(实验结论)
(1)由实验Ⅰ你可以得出的结论是__________能加快过氧化氢分解生成氧气的速率。
(2)实验Ⅱ、Ⅲ证明:氧化铜的___________和__________在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)过氧化氢在氧化铜的催化下分解放出氧气反应的文字表达式为_______。