题目内容
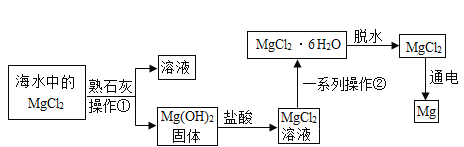
【题目】兴趣小组同学从海水晒盐后的盐卤中模拟工业生产来提取镁,主要流程如下:
(问题讨论)
(1)流程中的操作①是_______(填实验操作名称)。
(2)一系列操作②中包含蒸发浓缩 、______、过滤等。
(3)电解氯化镁可以得到镁和氯气,该反应的化学方程式为:________,该变化过程是_______能转化为化学能。
(4)镁的化学性质比较活泼,能在氮气中燃烧生成氮化镁,在氮化镁中氮元素的化合价为-3,则氮化镁的化学式为:_______。
(发现问题)镁是一种银白色有金属光泽的金属。但拿出的镁条总是有一层灰黑色的“外衣",这层灰黑色的外衣是什么物质呢?
(查阅资料)(1)Mg(OH)2:白色固体,难溶于水,受热会分解成氧化镁和水;
(2)MgCO3: 白色固体,微溶于水,受热会分解成氧化镁和二氧化碳;
(3)MgCO3的热稳定性比Mg(OH)2的热稳定性更强。
(提出猜想)
小组同学认为该固体不可能是MgO、Mg(OH)2或MgCO3,他们的理由是______;小组同学由铜生锈会产生Cu2(OH)2CO3联想到灰黑色的物质可能是Mg2(OH)2CO3。
(实验分析)
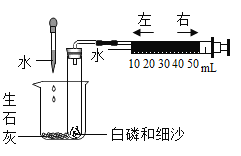
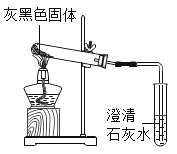
按图所示装置进行实验,发现试管口有液滴出现,说明反应产生了______;澄清石灰水变浑浊(变浑浊的化学方程式为__________);同时灰黑色固体完全变为白色。若灰黑色固体是Mg2(OH)2CO3,请写出Mg2(OH)2CO3受热分解的化学方程式__________。
(组成测定)
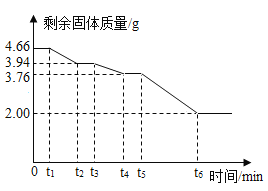
工业生产中得到的碱式碳酸镁晶体是xMgCO3yMg(OH)2zH2O,为精确测量晶体的组成,小组同学取4.66g该晶体,用热分析仪对固体进行热分解(加热使之逐步分解,首先失去结晶水,最后完全反应),测定剩余固体质量与分解温度之间关系。
(数据处理)剩余固体质量与加热时间关系如图所示:
请回答下列问题:
(1)0~t1固体质量没有发生变化的原因可能______。
(2)晶体中结晶水的质量为_________g。
(3)t4~t5段固体为______和MgO(写化学式)。
(4)根据图中数据推算xMgCO3yMg(OH)2zH2O中x∶y∶z的最简比= ______。(写简要过程)
【答案】过滤 降温结晶 MgCl2![]() Mg+ Cl2 ↑ 电 Mg3N2 MgO、Mg(OH)2或MgCO3均为白色固体,镁条外面是灰黑色 水 CO2+Ca(OH)2= CaCO3↓+H2O Mg2(OH)2CO3
Mg+ Cl2 ↑ 电 Mg3N2 MgO、Mg(OH)2或MgCO3均为白色固体,镁条外面是灰黑色 水 CO2+Ca(OH)2= CaCO3↓+H2O Mg2(OH)2CO3![]() 2MgO+H2O+CO2↑ 温度没有达到晶体分解所需的最低温度 0.72g MgCO3 4:1:4
2MgO+H2O+CO2↑ 温度没有达到晶体分解所需的最低温度 0.72g MgCO3 4:1:4
【解析】
[问题讨论]
(1)操作①将物质固液分离,故为过滤;
(2)②操作由溶液得到晶体,故②中包含蒸发浓缩 、降温结晶、过滤等;
(3)电解氯化镁可以得到镁和氯气,该反应的化学方程式为:MgCl2 ![]() Mg+ Cl2 ↑,该变化过程是将电能转化为化学能;
Mg+ Cl2 ↑,该变化过程是将电能转化为化学能;
(4)已知氮化镁中氮元素的化合价为-3,根据化合物化合价代数和为零,则氮化镁的化学式为:Mg3N2;
[提出猜想]
因MgO、Mg(OH)2或MgCO3均为白色固体,而镁条外面是灰黑色,则该固体不可能是MgO、Mg(OH)2或MgCO3;
[实验分析]
试管口有液滴出现,说明反应产生了水,澄清石灰水变浑浊则证明有二氧化碳生成,反应化学方程式为:CO2+Ca(OH)2= CaCO3↓+H2O,同时灰黑色固体完全变为白色,白色固体应是氧化镁,由上可知黑色固体受热生成了水、二氧化碳、氧化镁,故Mg2(OH)2CO3受热分解的化学方程式为:Mg2(OH)2CO3![]() 2MgO+H2O+CO2↑;
2MgO+H2O+CO2↑;
[数据处理]
分析图像可知,0-t1应是温度没有达到晶体分解所需的最低温度,故固体质量不变,t1-t2为固体中结晶水蒸发,结合已知资料MgCO3的热稳定性比Mg(OH)2的热稳定性更强,则t3-t4是氢氧化镁分解,t5-t6是碳酸镁分解。
(1)0~t1固体质量没有发生变化的原因可能度没有达到晶体分解所需的最低温度;
(2)t1-t2为固体中结晶水蒸发,质量为:4.66g-3.94g=0.72g;
(3)结合已知资料MgCO3的热稳定性比Mg(OH)2的热稳定性更强,则t3-t4是氢氧化镁分解,t5-t6是碳酸镁分解,则t4~t5段固体为MgCO3和MgO;
(4)碱式碳酸镁的相对分子质量为:84x+58y+18z,
氧化镁质量为:2.00g,则镁元素的质量为:![]() ,
,
二氧化碳质量为:3.76g-2.00g=1.76g,则碳元素的质量为:![]() ,
,
水的质量为:(4.66g-3.94g)+(3.94g-3.76g)=0.9g,则氢元素的质量为:![]() ,结合化学方程式则有:
,结合化学方程式则有:![]() ,
,
![]() ,
,
![]() ,
,
解得x=4,y=1,z=4,
即xMgCO3yMg(OH)2zH2O中x∶y∶z的最简比=4:1:4。

 优学名师名题系列答案
优学名师名题系列答案【题目】课本“分解过氧化氢制氧气的反应中二氧化锰的催化作用”以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)A中产生的气体是_____________。
(2)实验Ⅱ、Ⅲ证明:氧化铁的___________和____________在反应前后均没有发生变化,可以作过氧化氢溶液分解的催化剂。
(3)写出氧化铁催化过氧化氢溶液分解的符号表达式__________________________。
(实验评价)
(1)实验设计Ⅳ的目的是__________________________________________。
(2)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此你可以得到的结论是_______。
(实验拓展)
(1)查阅资料得知:CuO、CuSO4、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______________(填序号)。
A.MnO2只能作过氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其他反应的反应物或生成物
(2)实验创新是中学生最为重要的科学素养。下图是某学校的师生对“MnO2催化H2O2溶液分解实验装置的创新设计”,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取3ml(密度为1g/ml)质量分数为5%的H2O2加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥管的进气管的管壁上。
②点燃橡胶塞上棒香后,塞紧干燥管并将其竖立,观察到带火星的棒香立即复燃。
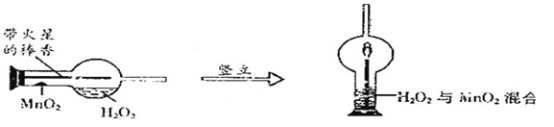
对该创新实验的评价,你认为不合理的是_________(填序号)。
A.实验中所用的仪器、材料及药品均易得到
B.实验使用的药品用量太大
C.反应速度太慢,耽误时间
D.实验现象明显,整个装置好似点燃的灯塔,趣味性强