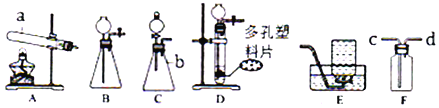
题目内容
【题目】甲、乙两种固体的溶解度曲线如图一所示:
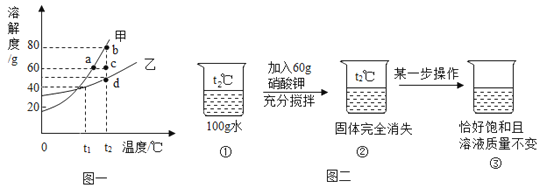
(1)t1℃时,溶解度大小关系为:甲______乙(填“>”、“<”或“=”);
(2)t2℃时,配制180g甲物质的饱和溶液,需称量甲的质量______g;
(3)由图二推测硝酸钾是图一中的______物质;
(4)图二“某一部操作”前后的溶液状态变化过程可以在图一中表示为______(填序号)。
A b点→a点 B c点→a点 C b点→c点 D c点→d点
【答案】> 80 甲 B
【解析】
甲、乙的溶解度都随温度升高而增大。
(1)由图像可知在t1℃时,甲的溶解度曲线在乙的上面,故溶解度大小关系为甲>乙。
(2)在t2℃时,甲的溶解度为80g,80g甲溶解到100g水中,形成的溶液恰好是180g的饱和溶液,故需要称量的质量就是80g。
(3)由图二可知该物质在t2℃时,溶解度大于60g,硝酸钾的溶解度随温度升高增加快,故甲物质为硝酸钾。
(4)对于硝酸钾这种物质来说由不饱和溶液转化为饱和溶液有以下几种途径,①降温②恒温蒸发溶剂③增加溶质,由于溶液质量不变,所以溶质质量和溶剂质量都不变,所以只能采用降温的方法,故选择c点→a点。

【题目】某研究性学习小组用如图所示装置进行如下实验(不考虑气体与水或盐的反应)。
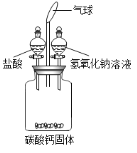
(1)先向广口瓶中加入一定量盐酸溶液,关闭活塞,震荡,观察到固体全部溶解,气球变大。然后再将一定量氢氧化钠溶液加入广口瓶中,关闭活塞,震荡,发现气球明显变小,同时在广口瓶中还能观察到的现象是___________________, 用化学方程式表示该现象产生的原因:_____________________________________。
(2)实验结束后,同学们对广口瓶中的溶液进行探究。
(提出问题)广口瓶中的溶液含有哪些溶质?
(交流讨论)小明取广口瓶中溶液少量加入试管内,向其广口瓶中加入过量稀盐酸,发现有气泡产生,由此他得出结论:广口瓶中溶液的溶质组成为Na2CO3、NaCl、CaCl2。大家一致认为小明的结论是不正确的,理由是________________________________。后经大家讨论,达成共识,对广口瓶溶液中溶质组成的判断只有两种结论,结论一:组成为__________________________两种溶质,结论二:组成为____________________________________ 三种溶质。
(3)(实验设计)
实验步骤 | 实验现象 | 实验结论 |
①取广口瓶中溶液少量于试管中,向其中加入过量的________溶液 | 有白色沉淀产生 | 结论一是正确的 |
②向步骤①所得的溶液中加______________ | ______________ |
反思讨论:第①步加入试剂要求过量的作用是:________________________________________________。
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
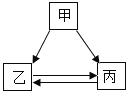
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D
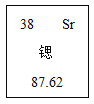
【题目】锶是一种特殊的金属,与钙的化学性质相似但比钙活泼,如图是元素周期表中“类钙”元素锶的相关信息。碳酸锶(SrCO3)可用于制造红色火焰、荧光玻璃等。小赵同学为测定某SrCO3和NaCl固体混合物中SrCO3的质量分数,在三个烧杯中进行相关实验,实验所用稀盐酸的溶质的质量分数相同。所得数据如下表所示:
烧杯编号 | ① | ② | ③ |
稀盐酸质量/g | 100 | 200 | 300 |
固体混合物质量/g | 100 | 100 | 100 |
反应后烧杯中物质的质量/g | 195.6 | 291.2 | 391.2 |
试求:
(1)锶原子质子数为_____,写出锶离子的符号_____。
(2)请写出碳酸锶(SrCO3)与稀盐酸反应的化学方程式_____。
(3)烧杯②中产生CO2的质量为_____g。
(4)请计算原固体混合物中SrCO3的质量分数(SrCO3的相对分子质量是148,计算结果精确到0.1%)。
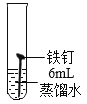
【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。老师说氯化物可能加快铁钉生锈的速度。大家将铁钉放入加有氯化铜溶液的蒸馏水中(如图所示)。观察到7分钟时铁钉表面出现红色,20分钟后试管底部出现红色沉淀。
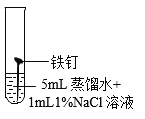
(提出问题)红色沉淀物是什么?
(做出猜想)小明认为可能是铁锈(写出铁锈主要成分的化学式:___________。
小陈认为可能是铜。
小陈认为红色沉淀物是铜的理由是______________(用文字描述)。
(设计实验)
实验操作 | 实验现象 |
取红色沉淀物于试管中,加入足量的稀盐酸 | 红色沉淀物大部分溶解,溶液变成黄色 |
(1)根据实验现象,红色沉淀物中一定含有铁锈,原因是______________(用化学方程式表示);经过讨论,同学们一致认为红色沉淀物是铁锈和铜的混合物。
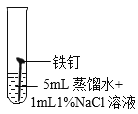
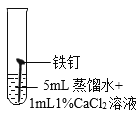
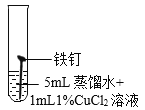
(继续探究)影响铁锈蚀的因素有哪些?
试管 编号 | ① | ② | ③ | ④ |
实验 |
|
|
|
|
现象 | 2天后,铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 1天后,铁钉表面出现红色 | 7分钟时铁钉表面出现红色,20分钟后试管底部出现红色沉淀 |
(2)实验①的作用是_______________。
(3)根据上述实验可以得到的结论是___________。
(4)根据上述实验,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是_____________。
(5)影响铁制品锈蚀快慢除上述因素外,还有_____________(写一 点即可),请设计实验方案进行验证_________。
【题目】小明同学拆开某食品的包装袋,发现袋里有一个装固体的小纸袋,上面写着“干燥剂,主要成分生石灰,请勿食”;小明决定对干燥剂进行探究。
(提出问题)这包干燥剂是否变质,成分是什么?
(猜想与假设)猜想一:全部是CaO;猜想二:CaO和Ca(OH)2;猜想三:全部是Ca(OH)2;猜想四:Ca(OH)2和CaCO3;猜想五:_____。
(实验探究)
实验操作及步骤 | 实验现象 | 实验结论 |
①取部分干燥剂于试管中,加水 | 无放热现象 | 猜想_____不正确 |
②向①中的溶液滴加稀HCl溶液 | 有气泡产生 | 猜想_____不正确 |
③另取部分干燥剂,加水并搅拌,静置后过滤,取上清液,通入足量的CO2 | _____ | 猜想四正确 |
写出实验③中发生反应的化学方程式:_____。
(拓展运用)小明同学反思了干燥剂变质的原因,认识到实验室保存氧化钙应注意_____。