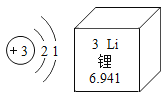
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΝρΥα―«ΧζοßΨßΧεΥΉΟϊΈΣΡΠΕϊ―ΈΘ§‘Ύ÷Τ“©ΓΔΒγΕΤΖΫΟφ”–ΙψΖΚΒΡ”Π”ΟΓΘ
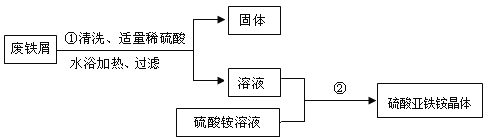
Ή ΝœΘΚ ΔΌΝρΥα―«ΧζοßΨßΧεΜ·―ß ΫΈΣFeSO4ΓΛ(NH4)2SO4ΓΛ6H2OΘ§œύΕ‘Ζ÷Ή”÷ ΝΩΈΣ392Θ§“Ή»ή”ΎΥ°Θ§≤Μ»ή”Ύ““¥ΦΘΜ
ΔΎœύΙΊΈο÷ ΒΡ»ήΫβΕ»Θ®ΒΞΈΜΘΚgΘ©»γœ¬±μΘΚ
Έ¬Ε»/Γφ | FeSO4 | (NH4) 2SO4 | FeSO4ΓΛ(NH4)2SO4ΓΛ6H2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
ΔέΝρΥα―«ΧζοßΨßΧε ή»» ±Θ§‘Ύ200Γφ“‘œ¬÷Μ”–ΫαΨßΥ° ß»ΞΓΘ
Ρ≥–Υ»Λ–ΓΉιΒΡ―ß…ζ”ΟΚ§”–…ΌΝΩΆ≠ΒΡΖœΧζ–Φ÷Τ±ΗΝρΥα―«ΧζοßΨßΧεΘ§Νς≥Χ»γœ¬ΘΚ
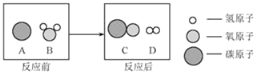
Θ®1Θ©≤ΌΉςΔΌ÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____ΘΜΙΐ¬ΥΥυ–η≤ΘΝß“«Τς”–…’±≠ΓΔ≤ΘΝßΑτΓΔ____ΘΜ
Θ®2Θ©≤ΌΉςΔΌ÷–Ιΐ¬Υ ±Θ§“Σ≥Ο»»Ϋχ––ΒΡ‘≠“ρ «____ΘΜ
Θ®3Θ©≤ΌΉςΔΎΒΡΡΩΒΡ «ΒΟΒΫΝρΥα―«ΧζοßΨßΧεΓΘ≤ΌΉςΥ≥–ρ «bΓζ ____ Γζ ____ ΓζdΘΜ
a Ιΐ¬Υ b Φ”»»≈®Υθ c ά以ΫαΨß d œ¥Β”Η…‘ο
Θ®4Θ©≤ΌΉςΔΎ÷– Ι”Ο““¥Φœ¥Β”Θ§’β―υΉωΒΡ”≈Βψ «____ΘΜΘ®―ΓΧνΉ÷ΡΗ–ρΚ≈Θ©
A ±ήΟβ”ΟΥ°œ¥Β”Υυ‘λ≥…ΒΡΨßΧεΥπΚΡ B ΨΤΨΪ“ΉΜ”ΖΔΘ§Ω…ΒΆΈ¬ΝάΗ…ΨßΧε
Θ®5Θ©ΗΟ Β―ι»ΓΖœΧζ–Φ15 gΘ§Ήν÷’ΒΟΒΫΝρΥα―«ΧζοßΨßΧε39.2 gΘ§‘ρ‘≠ΖœΧζ–Φ÷–Χζ‘ΣΥΊΒΡ÷ ΝΩΖ÷ ΐ≤ΜΒΆ”Ύ____Θ®ΨΪ»ΖΒΫ0.1%Θ§≤Μ“Σ«σ–¥Ιΐ≥ΧΘ©ΓΘ
ΓΨ¥πΑΗΓΩFe+H2SO4®TFeSO4+H2Γϋ ¬©ΕΖ Ζά÷ΙΈ¬Ε»ΫΒΒΆFeSO4ΨßΧεΈω≥ωΘ§≤ζΝΩΘ®≤ζ¬ Θ©ΫΒΒΆΜρ ΙFeSO4ΨΓΩ…ΡήΕύΒΡ»ήΫβΘ§ΧαΗΏ≤ζΝΩΘ®≤ζ¬ Θ© c a AB 37.3%
ΓΨΫβΈωΓΩ
Θ®1Θ©ΗυΨίΧζΚΆΝρΥαΖ¥”Π…ζ≥…ΝρΥα―«ΧζΚΆ«βΤχΫχ––Ζ÷ΈωΘΜΗυΨίΙΐ¬ΥΥυ–ηΒΡ≤ΘΝß“«Τς”–…’±≠ΓΔ≤ΘΝßΑτΓΔ¬©ΕΖΫχ––Ζ÷ΈωΘΜ
Θ®2Θ©ΗυΨίΝρΥα―«ΧζΒΡ»ήΫβΕ»Ϋχ––Ζ÷ΈωΘΜ
Θ®3Θ©ΗυΨί÷Τ»ΓΝρΥα―«ΧζΨßΧεΒΡΜυ±Ψ≤ΌΉςΫβ¥πΘΜ
Θ®4Θ©ΗυΨίΝρΥα―«ΧζΡ―»ή”ΎΨΤΨΪΘ§ΨΤΨΪ”–Μ”ΖΔ–‘Ϋχ––Ζ÷ΈωΘΜ
Θ®5Θ©ΗυΨίΝρΥα―«ΧζοßΨßΧε÷–Χζ‘ΣΥΊΒΡ÷ ΝΩΖ÷ ΐΚΆΖœΧζ–ΦΒΡ÷ ΝΩΫχ––Ζ÷ΈωΘ°
Θ®1Θ©ΧζΚΆΝρΥαΖ¥”Π…ζ≥…ΝρΥα―«ΧζΚΆ«βΤχΘ§Μ·―ßΖΫ≥Χ ΫΈΣΘΚFe+H2SO4®TFeSO4+H2ΓϋΘΜΙΐ¬ΥΥυ–ηΒΡ≤ΘΝß“«Τς”–…’±≠ΓΔ≤ΘΝßΑτΓΔ¬©ΕΖΘΜ
Θ®2Θ©ΗυΨίΝρΥα―«ΧζΒΡ»ήΫβ±μΗώΩ…÷ΣΘ§ΝρΥα―«Χζ‘Ύ50ΓφΒΫ80Γφ ±»ήΫβΕ» «±»Ϋœ¥σΒΡΘ§Υυ“‘≤ΌΉςΔΌ÷–Ιΐ¬Υ ±Θ§“Σ≥Ο»»Ϋχ––ΒΡ‘≠“ρ «Ζά÷ΙΈ¬Ε»ΫΒΒΆFeSO4ΨßΧεΈω≥ωΘ§≤ζΝΩΘ®≤ζ¬ Θ©ΫΒΒΆΜρ ΙFeSO4ΨΓΩ…ΡήΕύΒΡ»ήΫβΘ§ΧαΗΏ≤ζΝΩΘ®≤ζ¬ Θ©ΘΜ
Θ®3Θ©≤ΌΉςΔΎΒΡΡΩΒΡ «ΒΟΒΫΝρΥα―«ΧζοßΨßΧεΘ§Μυ±Ψ≤ΌΉς≤Ϋ÷ηΘΚΦ”»»≈®ΥθΘ§»ΜΚσά以ΫαΨßΘΜ‘ΌΙΐ¬ΥΘΜΉνΚσœ¥Β”Η…‘οΘΜΙ ΧνΘΚcΓΔaΓΘ
Θ®4Θ©ΝρΥα―«Χζ»ή”ΎΥ°≤Μ»ή”ΎΨΤΨΪΘ§”ΟAΖΫΖ®œ¥Β”ΝρΥα―«ΧζΨßΧεΥπ ßΫœΕύΘ§Ω…”ΟΨΤΨΪœ¥Β”Θ§ΨΤΨΪ”÷“ΉΜ”ΖΔΘ§ΡήΒΟΒΫ¥σΝΩΒΡ¥ΩΨΜΒΡΝρΥα―«ΧζΨßΧεΘ§Ι ―ΓΘΚABΘΜ
Θ®5Θ©‘≠ΖœΧζ–Φ÷–Χζ‘ΣΥΊΒΡ÷ ΝΩΖ÷ ΐ≤ΜΒΆ”Ύ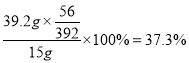 ΓΘ
ΓΘ

ΓΨΧβΡΩΓΩΜ·―ß–Υ»Λ–ΓΉιΒΡΆ§―ßΈΣΝΥΧΫΨΩ÷–ΚΆΖ¥”ΠΘ§»Γ“ΜΕ®ΝΩ«β―θΜ·ΡΤ»ή“Κ”Ύ…’±≠÷–Θ§œρΤδ÷–Φ”»κ“ΜΕ®ΝΩœΓΝρΥαΘ§ΖΔœ÷ΈόΟςœ‘œ÷œσΓΘΈΣ―ι÷Λ÷–ΚΆΖ¥”Π»Ζ ΒΡήΙΜΖΔ…ζΘ§ΥϊΟ«ΫΪ…’±≠÷–»ή“ΚΖ÷≥…»ΐΖίΘ§ΦΉΓΔ““ΓΔ±ϊ»ΐΟϊΆ§―ßΖ÷±πΫχ––“‘œ¬ Β―ιΓΘΙέ≤λΒΫΦΉ÷–ΈΣΚλ…ΪΘ§““÷–ΈόΟςœ‘œ÷œσΘ§±ϊ÷–”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…ΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΓΘ

(1)ΦΉΓΔ““ΓΔ±ϊ»ΐΗω Β―ι÷–Ρή÷ΛΟς«β―θΜ·ΡΤ”κΝρΥα»Ζ ΒΖΔ…ζΖ¥”ΠΒΡ «___ΓΘ
(2)Ψ≠Ζ÷ΈωΘ§…’±≠÷–ΒΡΖ¥”ΠΖΔ…ζΚσΘ§»ή“Κ÷–»ή÷ ≥…Ζ÷ΈΣ___ΓΘ
(3) Β―ιΚσΘ§ΦΉΓΔ““ΓΔ±ϊΆ§―ßΫΪ»ΐ÷ß ‘Ιή÷–ΒΡΖœ“Κ»Ϊ≤ΩΒΙ»κΆ§“ΜΫύΨΜ…’±≠÷–Θ§Ψ≤÷Ι“ΜΕΈ ±ΦδΚσΘ§Ιΐ¬ΥΓΘœρ¬Υ‘ϋ÷–Φ”»κΙΐΝΩœΓœθΥαΘ§≥ΝΒμ≤ΩΖ÷»ήΫβΘ§‘ρ¬Υ‘ϋ÷–“ΜΕ®Κ§”–ΒΡΈο÷ «___ΓΘ
(4)Ά§―ßΟ«”÷Ε‘¬Υ“Κ÷–»ή÷ ≥…Ζ÷Ϋχ––ΧΫΨΩΓΘ¬Υ“Κ÷–»ή÷ ≥…Ζ÷≥ΐΖ”ΧΣΆβΘ§“ΜΕ®ΜΙΚ§”–ΒΡ»ή÷ «___Θ§Ω…ΡήΚ§”–ΒΡ»ή÷ ”–“‘œ¬ΥΡ÷÷«ιΩωΘΚ
≤¬œκ“ΜΘΚ÷Μ”–ΝρΥαΡΤ
≤¬œκΕΰΘΚ____
≤¬œκ»ΐΘΚ___
≤¬œκΥΡΘΚ÷Μ”–¬»Μ·±ΒΓΘ
ΈΣΝΥ―ι÷Λ“‘…œ≤¬œκΡΡ“Μ÷÷’ΐ»ΖΘ§Ά§―ßΟ«Ϋχ–– Β―ιΦΧ–χΧΫΨΩΘ§Ήν÷’ΒΟ≥ω’ΐ»ΖΫα¬έΓΘ«κΆξ≥…“‘œ¬ΧΫΨΩΓΘ
Θ® Β―ιΧΫΨΩΘ©
Β―ι≤ΌΉς | Β―ιœ÷œσ | Β―ιΫα¬έ |
»Γ―υ”Ύ ‘Ιή÷–Θ§œ»ΒΈΦ”ΉψΝΩ__‘ΌΒΈΦ”¬»Μ·±Β»ή“ΚΓΘ | »ή“Κ”…Κλ…Ϊ±δΈΣΈό…ΪΘ§___ ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥… | ≤¬œκ“Μ’ΐ»Ζ |
ΓΨΧβΡΩΓΩ”–AΓΔBΝΫΤΩΈ¥÷ΣΈό…Ϊ“ΚΧεΘ§Ζ÷±π «ΧΦΥαΡΤ»ή“ΚΚΆ«β―θΜ·±Β»ή“ΚΘ§ΈΣΦχ±π≥ωΝΫ÷÷Έό…Ϊ“ΚΧεΘ§Ά§―ßΟ«…ηΦΤΝΥ»γΆΦΥυ ΨΦΉΓΔ““ΓΔ±ϊ»ΐ÷÷ Β―ιΖΫΑΗΓΘ
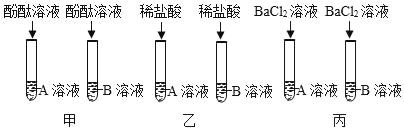
Θ®1Θ©ΦΉΓΔ““ΓΔ±ϊ»ΐ÷÷ΖΫΑΗ÷–Θ§≤ΜΩ…––ΒΡ «_____Θ§‘≠“ρ «_____ΓΘ
Θ®2Θ©«κ–¥≥ω±ϊΖΫΑΗ÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ_____ΓΘ
Θ®3Θ©–ΓΚλΆ§―ßΑ―±ϊΖΫΑΗΖ¥”ΠΚσΒΡΖœ“ΚΒΙ»κ“ΜΗωΫύΨΜΒΡ…’±≠÷–Θ§Ιΐ¬ΥΘ§ΒΟΑΉ…Ϊ≥ΝΒμΚΆΈό…Ϊ¬Υ“ΚΘ§Ά§―ßΟ«Ε‘¬Υ“Κ≥…Ζ÷Ϋχ––ΝΥΫχ“Μ≤ΫΒΡΧΫΨΩΓΘ
Θ®Χα≥ωΈ ΧβΘ©¬Υ“Κ÷–≥ΐΝΥNa+Θ§ΜΙΚ§”– ≤Ο¥άκΉ”ΘΩ
Θ®Ής≥ω≤¬œκΘ©
≤¬œκ“ΜΘΚΚ§”–OH©¹ΓΔCl©¹ΓΔCO32©¹
≤¬œκΕΰΘΚΚ§”–OH©¹ΓΔC1©¹ΓΔBa2+
≤¬œκ»ΐΘΚΚ§”–_____Θ®ΧνάκΉ”ΖϊΚ≈Θ©
Θ® Β―ιΧΫΨΩΘ©
Β―ι≤ΌΉς | Β―ιœ÷œσ | Ϋα¬έ |
»Γ…ΌΝΩ¬Υ“Κ”Ύ ‘Ιή÷–Θ§œρΤδ÷–ΒΈΦ”…ΌΝΩΒΡΝρΥαΡΤ»ή“Κ | ΈόΟςœ‘œ÷œσ | ≤¬œκ“Μ’ΐ»Ζ |
Θ®ΤάΦέΫΜΝςΘ©
ΔΌΡψ»œΈΣΆ§―ßΟ«ΒΡΫα¬έ_____Θ®ΧνΓΑ’ΐ»ΖΓ±ΜρΓΑ≤Μ’ΐ»ΖΓ±Θ©Θ§άμ”… «_____ΓΘ
ΔΎΆ§―ßΟ«Ψ≠ΙΐΧ÷¬έΚσ“Μ÷¬»œΈΣΘΚ»τΫΪΝρΥαΡΤ»ή“ΚΜΜ≥…ΉψΝΩΒΡ_____Θ§ΨΆΡή»ΖΕ®¬Υ“Κ÷–ΒΡάκΉ”≥…Ζ÷ΓΘ