题目内容
【题目】生产、生活、科技、环保等都离不开化学
能源、环境与人类的生活和社会发展密切相关。
①目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和_____。
②为减少污染、提高煤的利用率,可将其转化为可燃性气体水煤气,此过程可认为是碳 与水的反应,其微观示意图如图所示:
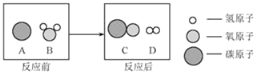
该反应的基本反应类型为_____;该反应生成物的分子个数比为_____。
③水煤气在不同催化剂作用下,可以合成不同物质,如重要有机物甲醇(CH3OH),写出该反应的化学方程式_____。有人认为仅利用水煤气在催化剂作用下不能合成尿素[CO(NH2)2],理由是_____。
【答案】天然气 置换反应 1:1 CO+2H2 CH3OH 化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素
CH3OH 化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素
【解析】
①根据常见的化石燃料来分析;
②根据微观反应示意图的信息来分析;
③根据化学方程式的写法以及质量守恒定律来分析。
①目前,人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和天然气;故填:天然气;
②根据图示可知,此反应是:C+H2O![]() CO+H2,该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应,由化学方程式可知,该反应生成物的分子个数比为1:1;故填:置换反应;1:1;
CO+H2,该反应是由一种单质与一种化合物反应生成另一种单质与另一种化合物,属于置换反应,由化学方程式可知,该反应生成物的分子个数比为1:1;故填:置换反应;1:1;
③根据信息:水煤气(CO和H2)在催化剂作用下,可以合成有机物甲醇(CH3OH)。化学方程式是:CO+2H2 CH3OH.水煤气中不含有氮元素而尿素中含有氮元素,根据化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素。
CH3OH.水煤气中不含有氮元素而尿素中含有氮元素,根据化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素。
故填:CO+2H2 CH3OH;化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素。
CH3OH;化学反应前后元素种类不变,反应物中没有氮元素,故不能得到尿素。

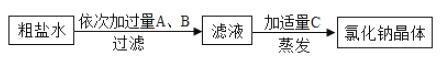
【题目】硫酸亚铁铵晶体俗名为摩尔盐,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体化学式为FeSO4·(NH4)2SO4·6H2O,相对分子质量为392,易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
温度/℃ | FeSO4 | (NH4) 2SO4 | FeSO4·(NH4)2SO4·6H2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
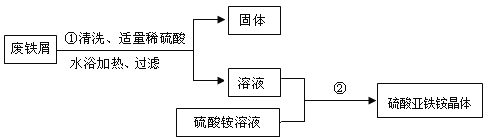
(1)操作①中发生反应的化学方程式为____;过滤所需玻璃仪器有烧杯、玻璃棒、____;
(2)操作①中过滤时,要趁热进行的原因是____;
(3)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ ____ → ____ →d;
a 过滤 b 加热浓缩 c 冷却结晶 d 洗涤干燥
(4)操作②中使用乙醇洗涤,这样做的优点是____;(选填字母序号)
A 避免用水洗涤所造成的晶体损耗 B 酒精易挥发,可低温晾干晶体
(5)该实验取废铁屑15 g,最终得到硫酸亚铁铵晶体39.2 g,则原废铁屑中铁元素的质量分数不低于____(精确到0.1%,不要求写过程)。
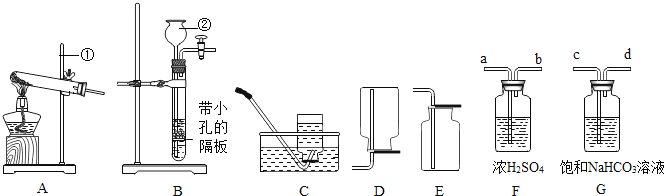
【题目】根据下图所示装置,结合所学化学知识回答下列问题:
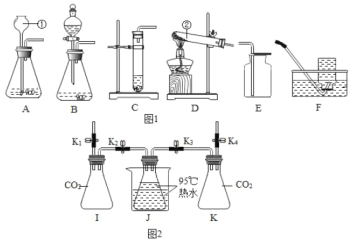
(1)写出图1中标号仪器的名称:①________。
(2)实验室用高锰酸钾制取氧气时,发生装置应选用____(填字母);其反应的化学方程式为________。如果改用氯酸钾和二氧化锰制取氧气,反应前后固体中二氧化锰的质量分数_____(填“增大”、“减小”或“不变”)。
(3)实验室制取少量二氧化碳时,发生装置最好选用____(填字母,下同),收集装置选用___,常用此收集方法的原因是________。
(4)CO2能与NaOH发生反应。
[实验过程]检查装置气密性,如图2所示连接好装置,进行实验。
序号 | 操作步骤 | 实验现象 |
Ⅰ | 打开弹簧夹K1,关闭弹簧夹K2、K3、K4.将20mL水注入锥形瓶I中,关闭弹簧夹K1,振荡瓶J,打开弹簧夹K2. | 无明显现象 |
Ⅱ | 关闭弹簧夹K2,打开弹簧夹K4,将20mL 稀NaOH溶液注入锥形瓶K中,关闭弹簧夹K4,振荡瓶J,打开弹簧夹K3. | 锥形瓶J中的热水剧烈沸腾 |
[实验分析]锥形瓶J的热水剧烈沸腾的原因是____________。
[实验反思]有观点认为只需要进行实验操作Ⅱ,即可说明CO2与NaOH发生反应。
你对该观点的看法是___________(选填“赞同”或“不赞同”),理由是__________。