题目内容
【题目】写出下列反应的化学方程式,并注明反应的基本类型.
(1)电解水制氢气;_____、_____
(2)镁带在空气中燃烧;_____、_____
(3)木炭在高温下与氧化铜反应._____、_____.
【答案】2H2O![]() 2H2↑+O2↑ 分解反应 2Mg+O2
2H2↑+O2↑ 分解反应 2Mg+O2![]() 2MgO 化合反应 C+2CuO
2MgO 化合反应 C+2CuO![]() 2Cu+CO2↑ 置换反应
2Cu+CO2↑ 置换反应
【解析】
(1)在通电条件下反应生成氢气和氧气,该反应的化学方程式为:2H2O![]() 2H2↑+O2↑;该反应由一种物质反应生成两种物质,符合分解反应的特点,属于分解反应;
2H2↑+O2↑;该反应由一种物质反应生成两种物质,符合分解反应的特点,属于分解反应;
(2)镁条的燃烧会生成氧化镁,该反应的化学方程式为:2Mg+O2![]() 2MgO;该反应由两种物质反应生成一种物质,符合化合反应的特点,属于化合反应;
2MgO;该反应由两种物质反应生成一种物质,符合化合反应的特点,属于化合反应;
(3)木炭在高温下与氧化铜反应,产物是铜与二氧化碳,该反应的化学方程式为:C+2CuO![]() 2Cu+CO2↑;该反应的反应物与生成物都是一种单质与一种化合物,符合置换反应的特点,属于置换反应。
2Cu+CO2↑;该反应的反应物与生成物都是一种单质与一种化合物,符合置换反应的特点,属于置换反应。

 阅读快车系列答案
阅读快车系列答案【题目】硫酸亚铁铵晶体俗名为摩尔盐,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体化学式为FeSO4·(NH4)2SO4·6H2O,相对分子质量为392,易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
温度/℃ | FeSO4 | (NH4) 2SO4 | FeSO4·(NH4)2SO4·6H2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
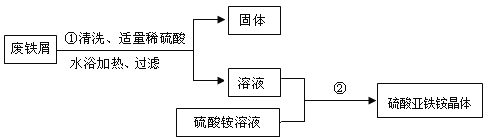
(1)操作①中发生反应的化学方程式为____;过滤所需玻璃仪器有烧杯、玻璃棒、____;
(2)操作①中过滤时,要趁热进行的原因是____;
(3)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ ____ → ____ →d;
a 过滤 b 加热浓缩 c 冷却结晶 d 洗涤干燥
(4)操作②中使用乙醇洗涤,这样做的优点是____;(选填字母序号)
A 避免用水洗涤所造成的晶体损耗 B 酒精易挥发,可低温晾干晶体
(5)该实验取废铁屑15 g,最终得到硫酸亚铁铵晶体39.2 g,则原废铁屑中铁元素的质量分数不低于____(精确到0.1%,不要求写过程)。