��Ŀ����
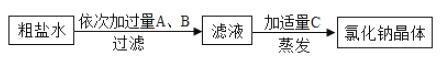
����Ŀ����A��B��ƿδ֪��ɫҺ�壬�ֱ���̼������Һ������������Һ��Ϊ�����������ɫҺ�壬ͬѧ���������ͼ��ʾ�ס��ҡ�������ʵ�鷽����
��1���ס��ҡ������ַ����У������е���_____��ԭ����_____��
��2����д���������з�����Ӧ�Ļ�ѧ����ʽ_____��
��3��С��ͬѧ�ѱ�������Ӧ��ķ�Һ����һ���ྻ���ձ��У����ˣ��ð�ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�ɷֽ����˽�һ����̽����
��������⣩��Һ�г���Na+��������ʲô���ӣ�
���������룩
����һ������OH����Cl����CO32��
�����������OH����C1����Ba2+
������������_____�������ӷ��ţ�
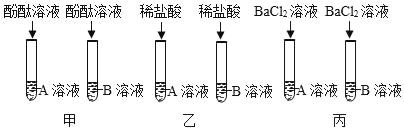
��ʵ��̽����
ʵ����� | ʵ������ | ���� |
ȡ������Һ���Թ��У������еμ���������������Һ | ���������� | ����һ��ȷ |
�����۽�����
������Ϊͬѧ�ǵĽ���_____��������ȷ����������ȷ������������_____��
��ͬѧ�Ǿ������ۺ�һ����Ϊ��������������Һ����������_____������ȷ����Һ�е����ӳɷ֡�
���𰸡��� ̼������Һ������������Һ�����Լ�����Һ������ʹ��̪��Һ���ɫ BaCl2+Na2CO3�TBaCO3��+2NaCl OH����C1�� ����ȷ ����������˵����Һ�в����б����ӣ���֤����Һ���Ƿ���̼������� ϡ����
��������
�Լ�����Һ��ʹ��̪��Һ���ɫ��
̼���ƺ��Ȼ�����Ӧ����̼�ᱵ�������Ȼ��ƣ�������������Ӧ����̼�ᱵ�������������ƣ�
ϡ�����̼���η�Ӧ�����Ρ�ˮ�Ͷ�����̼��������ˮ�ı��η�Ӧ�������ᱵ������
��1���ס��ҡ������ַ����У������е��Ǽף�ԭ����̼������Һ������������Һ�����Լ�����Һ������ʹ��̪��Һ���ɫ��
����ף�̼������Һ������������Һ�����Լ�����Һ������ʹ��̪��Һ���ɫ��
��2�����������Ȼ�����̼���Ʒ�Ӧ����̼�ᱵ�������Ȼ��ƣ�������Ӧ�Ļ�ѧ����ʽΪ��![]()
��3�����������롿
����һ������̼���ƹ���ʱ����OH����Cl����CO32��
��������Ȼ�������ʱ����OH����C1����Ba2+
���������Ȼ�����̼���ơ�̼���ƺ���������ǡ����ȫ��Ӧʱ����OH����C1����
���OH����C1����
�����۽�����
��ͬѧ�ǵĽ��۲���ȷ������������������˵����Һ�в����б����ӣ���֤����Һ���Ƿ���̼������ӡ�
�������ȷ������������˵����Һ�в����б����ӣ���֤����Һ���Ƿ���̼������ӡ�
��ͬѧ�Ǿ������ۺ�һ����Ϊ��������������Һ����������ϡ���ᣬ����ȷ����Һ�е����ӳɷ֣�������Ϊ����ϡ���ᣬ���������ɫ������˵����Һ�к��б����ӣ�����������ݣ�˵����Һ�к���̼������ӡ�
���ϡ���ᡣ

����Ŀ����������茶�������ΪĦ���Σ�����ҩ����Ʒ����й㷺��Ӧ�á�
���ϣ� ����������茶��廯ѧʽΪFeSO4��(NH4)2SO4��6H2O����Է�������Ϊ392��������ˮ���������Ҵ���
��������ʵ��ܽ�ȣ���λ��g�����±���
�¶�/�� | FeSO4 | (NH4) 2SO4 | FeSO4��(NH4)2SO4��6H2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
����������茶�������ʱ����200������ֻ�нᾧˮʧȥ��
ij��ȤС���ѧ���ú�������ͭ�ķ���м�Ʊ���������茶��壬�������£�
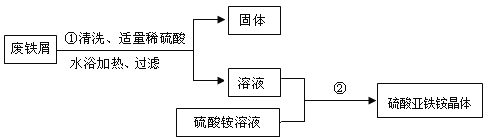
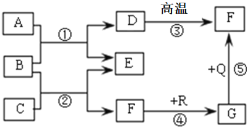
��1���������з�����Ӧ�Ļ�ѧ����ʽΪ____���������貣���������ձ�����������____��
��2���������й���ʱ��Ҫ���Ƚ��е�ԭ����____��
��3�������ڵ�Ŀ���ǵõ���������茶��塣����˳����b�� ____ �� ____ ��d��
a ���� b ����Ũ�� c ��ȴ�ᾧ d ϴ�Ӹ���
��4����������ʹ���Ҵ�ϴ�ӣ����������ŵ���____����ѡ����ĸ��ţ�
A ������ˮϴ������ɵľ������ B �ƾ��ӷ����ɵ������ɾ���
��5����ʵ��ȡ����м15 g�����յõ���������茶���39.2 g����ԭ����м����Ԫ�ص���������������____����ȷ��0.1%����Ҫ��д���̣���