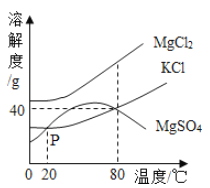
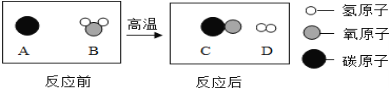
题目内容
【题目】化学兴趣小组的同学为了探究中和反应,取一定量氢氧化钠溶液于烧杯中,向其中加入一定量稀硫酸,发现无明显现象。为验证中和反应确实能够发生,他们将烧杯中溶液分成三份,甲、乙、丙三名同学分别进行以下实验。观察到甲中为红色,乙中无明显现象,丙中有白色沉淀生成。请回答下列问题。

(1)甲、乙、丙三个实验中能证明氢氧化钠与硫酸确实发生反应的是___。
(2)经分析,烧杯中的反应发生后,溶液中溶质成分为___。
(3)实验后,甲、乙、丙同学将三支试管中的废液全部倒入同一洁净烧杯中,静止一段时间后,过滤。向滤渣中加入过量稀硝酸,沉淀部分溶解,则滤渣中一定含有的物质是___。
(4)同学们又对滤液中溶质成分进行探究。滤液中溶质成分除酚酞外,一定还含有的溶质是___,可能含有的溶质有以下四种情况:
猜想一:只有硫酸钠
猜想二:____
猜想三:___
猜想四:只有氯化钡。
为了验证以上猜想哪一种正确,同学们进行实验继续探究,最终得出正确结论。请完成以下探究。
(实验探究)
实验操作 | 实验现象 | 实验结论 |
取样于试管中,先滴加足量__再滴加氯化钡溶液。 | 溶液由红色变为无色,___ 有白色沉淀生成 | 猜想一正确 |
【答案】乙 Na2SO4、NaOH BaCO3、BaSO4 NaOH、NaCl 只有碳酸钠 碳酸钠和硫酸钠(可互换) 稀硝酸 无气泡产生
【解析】
(1)甲中溶液变红色,说明溶液呈碱性,溶液仍存在氢氧化钠,不能证明氢氧化钠与硫酸确实发生反应;硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,乙中无明显现象,说明了溶液中不存在硫酸,证明氢氧化钠与硫酸确实发生反应;硫酸和硫酸钠都能与氯化钡溶液产生白色沉淀,丙出现白色沉淀,不能说明硫酸是否被消耗,不能证明氢氧化钠与硫酸确实发生反应。甲、乙、丙三个实验中能证明氢氧化钠与硫酸确实发生反应的是乙;
(2)氢氧化钠与硫酸反应生成硫酸钠和水,甲中溶液变红色,说明溶液呈碱性,溶液仍存在氢氧化钠,烧杯中的反应发生后,溶液中溶质成分为Na2SO4、NaOH;
(3)碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,硫酸钠与氯化钡反应生成硫酸钡和氯化钠,硫酸钡不溶于稀硝酸,碳酸钡与稀硝酸反应生成硝酸钡、水和二氧化碳,碳酸钡能溶于稀硝酸。实验后,甲、乙、丙同学将三支试管中的废液全部倒入同一洁净烧杯中,静止一段时间后,过滤。向滤渣中加入过量稀硝酸,沉淀部分溶解,则滤渣中一定含有的物质是BaCO3、BaSO4;
(4)根据第(1)小题的分析可知,溶液中一定存在氢氧化钠,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,硫酸钠与氯化钡反应生成硫酸钡和氯化钠,滤液中溶质成分除酚酞外,一定还含有的溶质是NaOH、NaCl;当硫酸钠过量时,溶液中还一定存在硫酸钠,当碳酸钠过量时,溶液中还一定存在碳酸钠;当硫酸钠和碳酸钠同时过量时,溶液中还一定存在硫酸钠和碳酸钠,当氯化钡过量时,溶液中还一定存在氯化钡。猜想二:只有碳酸钠
猜想三:碳酸钠和硫酸钠;
实验探究:
若证明猜想一正确,加入氯化钡溶液产生白色沉淀,需排除去碳酸钠的干扰,所以先加入过量稀硝酸,若溶液由红色变为无色,不产生气泡,有白色沉淀生成,则猜想一正确。因此:
实验操作 | 实验现象 | 实验结论 |
取样于试管中,先滴加足量稀硝酸再滴加氯化钡溶液。 | 溶液由红色变为无色,不产生气泡,有白色沉淀生成 | 猜想一正确 |

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】硫酸亚铁铵晶体俗名为摩尔盐,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体化学式为FeSO4·(NH4)2SO4·6H2O,相对分子质量为392,易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
温度/℃ | FeSO4 | (NH4) 2SO4 | FeSO4·(NH4)2SO4·6H2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78 | 28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
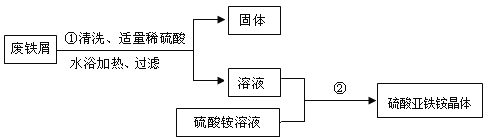
(1)操作①中发生反应的化学方程式为____;过滤所需玻璃仪器有烧杯、玻璃棒、____;
(2)操作①中过滤时,要趁热进行的原因是____;
(3)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ ____ → ____ →d;
a 过滤 b 加热浓缩 c 冷却结晶 d 洗涤干燥
(4)操作②中使用乙醇洗涤,这样做的优点是____;(选填字母序号)
A 避免用水洗涤所造成的晶体损耗 B 酒精易挥发,可低温晾干晶体
(5)该实验取废铁屑15 g,最终得到硫酸亚铁铵晶体39.2 g,则原废铁屑中铁元素的质量分数不低于____(精确到0.1%,不要求写过程)。