��Ŀ����
����Ŀ��Ϊ̽����Ļ�ѧ����,ij��ѧС�������������������ʵ���������ش�:
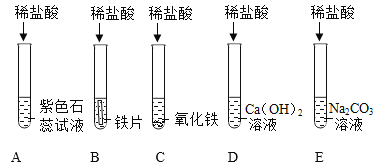
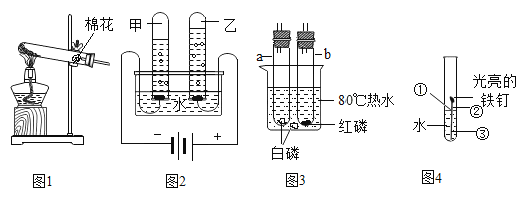
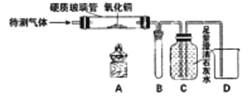
(1)д��C�з�Ӧ�Ļ�ѧ����ʽ___________________��
(2)װ��B�еķ�Ӧ����:���ȹ۲쵽__________________,���۲쵽___________________��������Ӧ�Ļ�ѧ����ʽ��___________________��
(3)����Ӧ��D.E�Թ��еķ�Һ����һ���ྻ���ձ���,�۲쵽�ձ����������ݲ���,���а�ɫ�������֡����ձ��еĻ�������,�õ���ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�����ʵijɷֽ�������̽��:
��������⣩��Һ�����ʵijɷ���ʲô?
���������룩
����һ:NaCl
�����:NaC1��CaCl2
������:NaC1��CaCl2��Na2CO3
������:______________(�ѧʽ)
���������ۣ���������,ͬѧ��һ����Ϊ����____________________�Ǵ���ġ�
�����ʵ�飩�����ʵ�鱨�档
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ���,�μ�������̼������Һ | ���������� | ����������� |
ȡ������Һ���Թ���,�μ��Ȼ�����Һ | ________________ | �����ij��� |
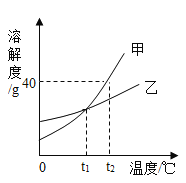
(4)ij������������10%������������Һϴ��һ����ʯ�Ͳ�Ʒ�еIJ������ᣬ����������������Һ40g,ϴ�Ӻ����Һ�����ԡ�������Щʯ�Ͳ�Ʒ�к�����������Ƕ���?___________
���𰸡�![]() ���� ��Һ����ɫ��dz��ɫ
���� ��Һ����ɫ��dz��ɫ ![]() NaCl��Na2CO3 �� �а�ɫ�������� 4.9g
NaCl��Na2CO3 �� �а�ɫ�������� 4.9g
��������
��1��C����������ϡ���ᷴӦ�����Ȼ�����ˮ������ʽΪ��![]() ��
��
��2����Ƭ��ϡ���ᷴӦ�����Ȼ���������������ѧ����ʽΪ![]() �����ȹ۲쵽����,���۲쵽��Һ����ɫ��Ϊdz��ɫ��������ݣ���Һ����ɫ��Ϊdz��ɫ��
�����ȹ۲쵽����,���۲쵽��Һ����ɫ��Ϊdz��ɫ��������ݣ���Һ����ɫ��Ϊdz��ɫ��![]() ��
��
��3��[���������]�۲쵽�ձ����������ݲ��������а�ɫ�������֣�˵��D����������� E��̼���ƹ�������Ϻ������̼���Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��������ȫ��Ӧ��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ�����һ���Ȼ��ƺ�̼������ȫ��Ӧʱ�����ǣ�NaCl����������Ȼ��ƹ���ʱ������NaCl��CaCl2����������̼���ƹ���ʱ������NaCl��Na2CO3���NaCl��Na2CO3��
[�����뽻��]�Ȼ��ƺ�̼�����ܷ�Ӧ����̼��ƺ��Ȼ��ƣ����߲��ܹ��棬���Բ�����һ�����������
[ʵ�������]��Ϊ�����ij�������Һ��һ������̼���ƣ�ȡ������Һ���Թ��У��μ������Ȼ�����Һ��̼���ƺ��Ȼ��������ɰ�ɫ̼�ᱵ�������Ȼ��ƣ�����а�ɫ�������� ��
��4���⣺����������Ϊx��
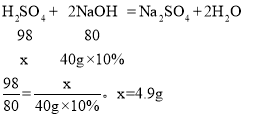
���4.9g��

 ��Ӣ���㿨ϵ�д�
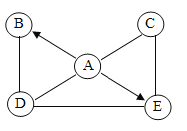
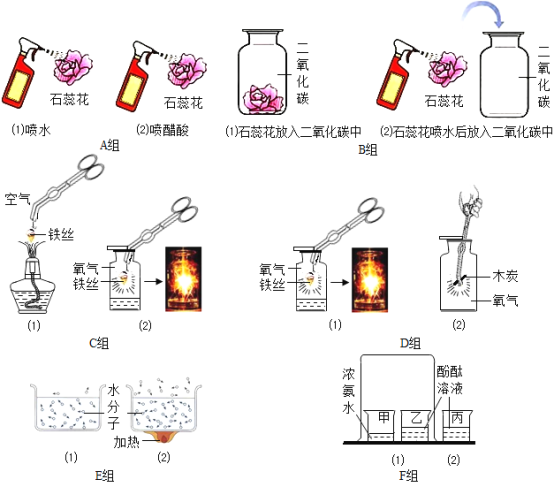
��Ӣ���㿨ϵ�д�����Ŀ���Ա�������������Ŀ�ѧ�����������������ͼA��F�����飬����±�ʵ����ƣ�
ʵ����� | ̽��Ŀ�� | ѡ�öԱ�ʵ�飨������ţ� |
1 | ��ͬ���¶ȣ��Է����˶���Ӱ�� | __ |
2 | __ | C�� |
3 | �����CO2�ܷ�ʹʯ���� | __ |
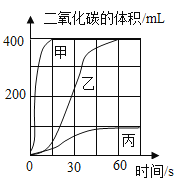
����Ŀ��ʵ�����Ʊ����ռ�������̼,���±�����ʵ�顣ȡ��������ͬ�ִ���ʯ������������(���ʲ����ᷴӦ),����������̼�����ʱ��仯������ͼ��ʾ������˵���������
ʵ���� | ҩƷ |
�� | ��״����ʯ��10% H2 SO4��Һ |
�� | ��״����ʯ��7% HCl��Һ |
�� | ����ʯ��ĩ��7% HCl��Һ |
A.ʵ����Ӧ����ͼ�仯����Ϊ��
B.ʵ��II�͢�Ա�,˵��Ӱ�췴Ӧ���ʵ������ǹ���Ŀ�����С
C.ʵ��I�͢�Ա�,˵��Ӱ�췴Ӧ���ʵ����������Ũ��
D.ʵ���͢���ȫ��Ӧ��,����������̼����������ȵ�