题目内容
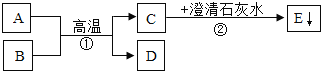
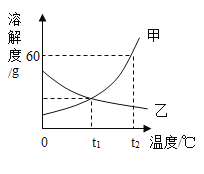
【题目】对比试验是最基本的科学分析方法,请根据下图A﹣F组试验,完成下表实验设计.
实验序号 | 探究目的 | 选用对比实验(填组序号) |
1 | 不同的温度,对分子运动的影响 | __ |
2 | __ | C组 |
3 | 干燥的CO2能否使石蕊变红 | __ |
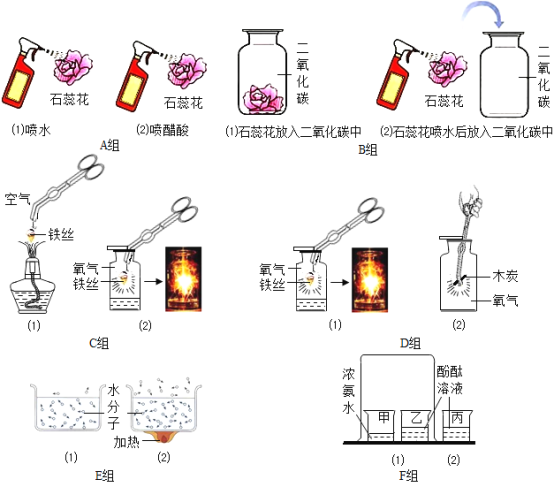
【答案】E组 反应物的浓度对反应的影响 B组
【解析】
1、E组中,探究不同的温度,对分子运动的影响。由图可知,温度越高,分子运动越剧烈,故填:E组;
2、C组中,探究反应物的浓度对反应的影响。由图可知,氧气浓度越高,反应越剧烈,铁丝在空气中不能燃烧,在氧气中剧烈燃烧,故填:反应物的浓度对反应的影响;
3、B组中,探究干燥的CO2能否使石蕊变红。由图可知,干燥的二氧化碳不能使石蕊变色,石蕊花喷水后放入二氧化碳中,二氧化碳和水反应生成碳酸,碳酸使石蕊变红色,故填:B组。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】请回答下列问题:
(1)铝热反应是焊接铁路上钢轨的反应原理:即在高温下铝与氧化铁发生反应生成氧化铝和铁,写出该反应的化学方程式_____该反应属于_____反应(填基本类型)
(2)下面是部分金属的部分物理性质:
物理性质 | 物理性质比较 |
导电性 |
|
密度 |
|
由上表可知:用铝作高空电缆是因为_____、_____。
(3)认真观察分析比较下列几个反应及现象:
A “真金不怕火炼”金在高温下也不与氧气发生反应。Au+O2![]() (不反应)
(不反应)
B 金属镁在空气中燃烧,发出耀眼的强光,放出大量的热量。2Mg+O2![]() 2MgO
2MgO
C 铜在加热条件下与氧气发生反应,在表面变黑。2Cu+O2![]() 2CuO
2CuO
D 铝在空气中与氧气发生反应,在表面生成一层致密的氧化膜。2Al+3O2=2Al2O3
从上述实验事实可以看出,四种金属的活动性顺序是_____。
【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作,请回答:
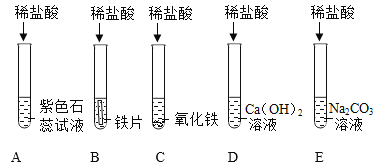
(1)写出C中反应的化学方程式___________________。
(2)装置B中的反应现象:首先观察到__________________,随后观察到___________________,发生反应的化学方程式是___________________。
(3)将反应后D.E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出向题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaC1和CaCl2
猜想三:NaC1、CaCl2和Na2CO3
猜想四:______________(填化学式)
(进行讨论)经过讨论,同学们一致认为猜想____________________是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ________________ | 猜想四成立 |
(4)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。计算这些石油产品中含硫酸的质量是多少?___________