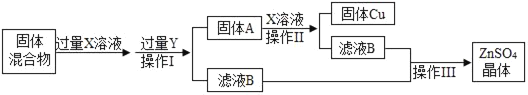
题目内容
【题目】金属及其制品是现代生活中不可缺少的材料和工具。
(1)汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和_______性
(2)铝制品一般无需做防锈处理,原因是铝在空气中生成了________(填化学式)
(3)某同学将铁刀放入一种溶液中,结果“铁刀变铜刀”,其可能的反应的方程式为______
【答案】导电性 Al2O3 Fe+CuSO4=FeSO4+Cu
【解析】
(1)汽车电路中的导线大都是铜制的,这是利用了金属铜的延展性和导电性。
(2)铝制品一般无需做防锈处理,原因是铝在空气中生成了致密的氧化铝,能够保护内部的铝不被氧化,其中铝元素显+3价,氧元素显-2价,氧化铝的化学式为Al2O3。
(3)某同学将铁刀放入一种溶液中,结果“铁刀变铜刀”,则是铁与硫酸铜溶液反应生成硫酸亚铁和铜,其反应的方程式为![]() 。
。

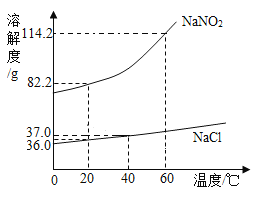
【题目】为探究酸的化学性质,某化学小组利用盐酸进行了如下实验操作,请回答:
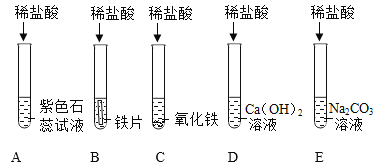
(1)写出C中反应的化学方程式___________________。
(2)装置B中的反应现象:首先观察到__________________,随后观察到___________________,发生反应的化学方程式是___________________。
(3)将反应后D.E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行如下探究:
(提出向题)滤液中溶质的成分是什么?
(作出猜想)
猜想一:NaCl
猜想二:NaC1和CaCl2
猜想三:NaC1、CaCl2和Na2CO3
猜想四:______________(填化学式)
(进行讨论)经过讨论,同学们一致认为猜想____________________是错误的。
(设计实验)请完成实验报告。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量的碳酸钠溶液 | 无明显现象 | 猜想二不成立 |
取少量滤液于试管中,滴加氯化钡溶液 | ________________ | 猜想四成立 |
(4)某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40g,洗涤后的溶液呈中性。计算这些石油产品中含硫酸的质量是多少?___________
【题目】“84”消毒液在日常生活中使用广泛,具有漂白、杀菌、消毒功效。某化学兴趣小组对一瓶敞口久置的“84”消毒液成分产生兴趣,在老师的指导下进行如下探究:
(提出问题)该敞口久置的“84”消毒液中溶质有哪些?
(查阅资料)“84”消毒液主要成分是次氯酸钠(NaClO)和氯化钠,NaClO为有效成分,有腐蚀性并易与空气中CO2反应(2NaClO+CO2+H2O=2HClO+Na2CO3)。次氯酸(HClO)溶液和次氯酸钠(NaClO)溶液都具有漂泊、杀菌、消毒功效。HClO不稳定,受热或光照易分解。
(分析讨论)小组同学经过讨论,认为:一定含有____,可能还有NaClO、HClO、Na2CO3中的一种或几种。
(设计方案)为验证猜想,设计如下方案:
实验操作 | 实验现象 | 结论 |
Ⅰ、向盛有有色布条的烧杯中滴加该消毒液适量,放置一段时间 | 布条不褪色 | 该消毒液中___ |
Ⅱ、另取该消毒液少量于试管中,滴加足量氯化钙溶液,震荡 | _ | 该消毒液中含有Na2CO3 |
实验Ⅱ中的反应化学方程式为____;
(得出结论)综上所述,该敞口久置的“84”消毒液中溶质有__。
(交流反思)生活中,“84”消毒液贮藏时应注意_。一般不要“84”消毒液对蔬菜、水果进行消毒,其原因可能是_。
(拓展延伸)(1)次氯酸钠与稀硫酸可发生复分解反应,化学方程式为____
(2)次氯酸钠与盐酸反应可生成有毒的氯气,日常生活中“84”消毒液不能与洁厕灵(主要成分为盐酸)混合使用。
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____。
(查阅资料)CaCl2溶液显中性。
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;猜想Ⅱ:有CaCl2和HCl;猜想Ⅲ:有CaCl2和Ca(OH)2;猜想Ⅳ:有CaCl2、HCl和Ca(OH)2。
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是_______。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
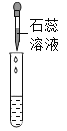
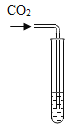
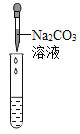
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | ①______ | ②_______ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想Ⅲ是正确的。
(评价反思)(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因:_____。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑____。